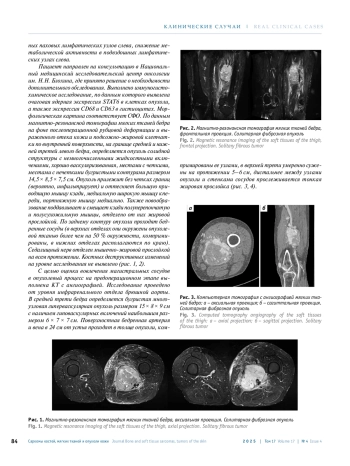
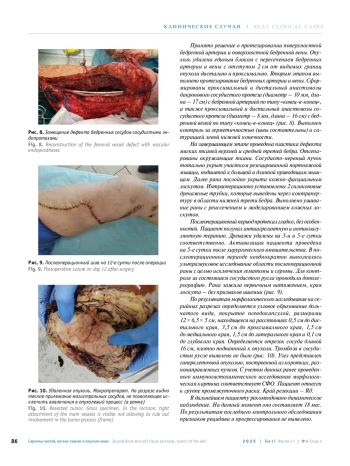
1. Gengler C., Guillou L. Solitary fibrous tumour and haemangiopericytoma: evolution of a concept. Histopathology 2006;48(1):63-74. DOI: 10.1111/j.1365-2559.2005.02298.x.
2. Suster S., Nascimento A.G., Miettinen M. et al. Solitary fibrous tumors of soft tissue. A clinicopathologic and immunohistochemical study of 12 cases. Am J Surg Pathol 1995;19(11):1257-66. DOI: 10.1097/00000478-199511000-00005.
3. Rekhi B., Shetty O., Tripathi P. et al. Molecular characterization of a series of solitary fibrous tumors, including immunohistochemical expression of STAT6 and NATB2-STAT6 fusion transcripts, using reverse transcriptase(RT)-polymerase chain reaction(PCR) technique: an Indian experience. Pathol Res Pract 2017;213(11):1404-11. DOI: 10.1016/j.prp.2017.08.011.
4. Martin-Broto J., Mondaza-Hernandez J.L., Moura D.S., Hindi N. A comprehensive review on solitary fibrous tumor: new insights for new horizons. Cancers (Basel) 2021;13(12):2913. DOI: 10.3390/cancers13122913.
5. Demicco E.G., Park M.S., Araujo D.M. et al. Solitary fibrous tumor: a clinicopathological study of 110 cases and proposed risk assessment model. Mod Pathol 2012;25(9):1298-306. DOI: 10.1038/modpathol.2012.83.
6. Mlees M.A., Elbarbary A.H., Sallam E.M. Vascular reconstruction using autologous vs synthetic graft for patients with extremity soft-tissue sarcoma involving the major vessels. J Surg Oncol 2020; 121(2):272-278.
7. Козлов Н.А., Цыганкова А.В., Абдуллаев А.Г. Солитарная фиброзная опухоль: особенности клинического течения, лучевой и лабораторной диагностики, терапия. Современная онкология 2021;23(4):655-9. DOI: 10.26442/18151434.2021.4.201069.
8. Stacchiotti S., Tortoreto M., Bozzi F. et al. Dacarbazine in solitary fibrous tumor: a case series analysis and preclinical evidence vis-a-vis temozolomide and antiangiogenics. Clin Cancer Res 2013;19(18):5192-201. DOI: 10.1158/1078-0432.CCR-13-0776.
9. Stacchiotti S., Negri T., Libertini M. et al. Sunitinib malate in solitary fibrous tumor (SFT). Ann Oncol 2012;23(12):3171-9.DOI: 10.1093/annonc/mds143.
10. Valentin T., Fournier C., Penel N. et al. Sorafenib in patients with progressive malignant solitary fibrous tumors: a subgroup analysis from a phase II study of the French Sarcoma Group (GSF/GETO). Invest New Drugs 2013;31(6):1626-7. Doi: 10.1007/s10637-013-0023-z.
11. Martin-Broto J., Cruz J., Penel N. et al. Pazopanib for treatment of typical solitary fibrous tumours: a multicentre, single-arm, phase 2 trial. Lancet Oncol 2020;21(3):456-66. DOI: 10.1016/S1470-2045(19)30826-5.
12. Stacchiotti S., Sommer J. Recurrent and advanced solitary fibrous tumor: multidisciplinary management and future perspectives. Curr Opin Oncol 2015;27(4):316-21. DOI: 10.1016/j.ejca.2018.10.024.