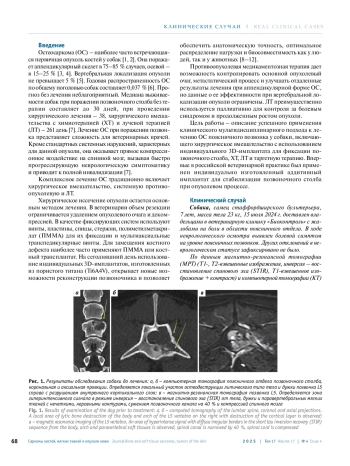
Остеосаркома – наиболее распространенная первичная опухоль костей у собак. В 15–25 % случаев она локализуется в осевом скелете. Поражение позвонков наблюдается реже и составляет менее 5 % случаев.
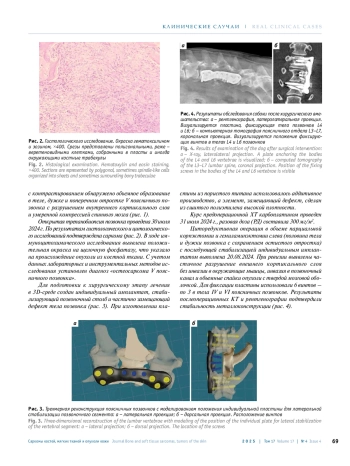
В статье представлено описание комплексного лечения остеосаркомы V поясничного позвонка у 7-летней собаки. Диагностические мероприятия включали компьютерную томографию, магнитно-резонансную томографию и открытую биопсию. Проведены предоперационная химиотерапия карбоплатином, циторедуктивное хирургическое вмешательство с применением индивидуальной аддитивно изготовленной пластины из пористого титана и последующими лучевой, химио- (карбоплатин, доксорубицин, доцетаксел) и таргетной (дазатиниб, тоцераниб, бевацизумаб) терапией. Удовлетворительный уровень жизни составил 311 дней, общая выживаемость – 400 дней. Представленный клинический случай демонстрирует высокую эффективность мультидисциплинарного подхода к лечению остеосаркомы позвонка у собаки.
Идентификаторы и классификаторы
Остеосаркома (ОС) – наиболее часто встречающаяся первичная опухоль костей у собак [1, 2]. Она поражает аппендикулярный скелет в 75–85 % случаев, осевой – в 15–25 % [3, 4]. Вертебральная локализация опухоли не превышает 5 % [5]. Годовая распространенность ОС по общему поголовью собак составляет 0,037 % [6]. Прогноз без лечения неблагоприятный. Медиана выживаемости собак при поражении позвоночного столба без терапии составляет до 30 дней, при проведении хирургического лечения – 38, хирургического вмешательства с химиотерапией (ХТ) и лучевой терапией (ЛТ) – 261 день [7]. Лечение ОС при поражении позвонка представляет сложность для ветеринарных врачей. Кроме стандартных системных нарушений, характерных для данной опухоли, она оказывает прямое компрессионное воздействие на спинной мозг, вызывая быстро прогрессирующую неврологическую симптоматику и приводит к полной инвалидизации [7].
Список литературы
1. Boerman I., Selvarajah G.T., Nielen M. et al. Prognostic factors in canine appendicular osteosarcoma - a meta-analysis BMC Vet Res 2012;15:8:56. DOI: 10.1186/1746-6148-8-56.
2. Ягников С.А., Лукоянова М.Л., Вилковыский И.Ф. и др. Опухоли спинного мозга и позвоночного столба у собак. Российский ветеринарный журнал. Мелкие домашние и дикие животные 2005(4):7-11.
3. Cavalcanti J.N., Ingrid Amstalden E.M., Guerra J.L. et al. Osteosarcoma in dogs: clinical-morphological study and prognostic correlation. Braz J Vet Res Anim Sci 2004;41(5). DOI: 10.1590/S1413-95962004000500002.
4. Edmunds G.L., Smalley M.J., Beck S. et al. Dog breeds and body conformations with predisposition to osteosarcoma in the UK: a case-control study Canine Genet Epidemiol 2021;10;8(1):2. DOI: 10.1186/s40575-021-00100-7.
5. Wolke R.E., Nielsen S.W. Site incidence of canine osteosarcoma. J Small Anim Pract 1966;7(7):489-92. DOI: 10.1111/j.1748-5827.1966.tb04475.x.
6. O’Neill D.G., Edmunds G.L., Jade Urquhart-Gilmore J. et al. Dog breeds and conformations predisposed to osteosarcoma in the UK: a VetCompass study. Canine Med Genet 2023;10:8. DOI: 10.1186/s40575-023-00131-2.
7. Dixon B.C., Tomlinson J.L., Fox D.B. et al. Surgical decompression, with or without adjunctive therapy, for palliative treatment of primary vertebral osteosarcoma in dogs Vet Comp Oncol 2019;17(4):472-8. DOI: 10.1111/vco.12508.
8. Burnard J.L., Parr W.C.H., Choy W.J. et al. 3D-printed spine surgery implants: a systematic review of the efficacy and clinical safety profile of patient-specific and off-the-shelf devices. Eur Spine J 2020;29(6):1248-60. DOI: 10.1007/s00586-019-06236-2.
9. Seex K.A., Mobbs R.J., Coughlan M. et al. Clinical outcomes of 3D-printed titanium patient-specific implants in lumbar interbody fusion: a prospective clinical trial with a systematic review of conventional techniques. J Pers Med 2025;15(7):320. DOI: 10.3390/jpm15070320.
10. Wang X., Sun S., Jiang Y. et al. Early clinical efficacy of 3D-printed artificial vertebral body in spinal reconstruction after total en bloc spondylectomy for spinal tumors. BMC Musculoskelet Disord 2024;19;25(1):926. DOI: 10.1186/s12891-024-08069-7.
11. Доценко И.А., Котомцев В.В., Медвинский И.Д. др. Использование аддитивных технологий в персонифицированной хирургии позвоночника (экспериментальное исследование). РМЖ. Медицинское обозрение 2020;4(2):83-8. DOI: 10.32364/2587-6821-2020-4-2-83-88.
12. Шевелева В.С., Пелешок С.А., Титова М.В. и др. Обзор экспериментальных моделей исследования эффективности и безопасности титановых имплантатов. Лабораторные животные для научных исследований 2024;3. DOI: 10.57034/2618723X-2024-03-07.
13. Расческова К.К., Хасанов Р.Ш., Сафин И.Р. и др. Лечение метастатического поражения позвонка при раке легкого (обзор литературы). Поволжский онкологический вестник 2024;15(1):3-26.
14. Matsumoto M., Tsuji T., Hongo M. et al. Outcomes after total en bloc spondylectomy at a mean follow-up of 11 years: a multicenter study. J Neurosurg Spine 2025;43(2):223-31. DOI: 10.3171/2025.3.SPINE24876.
15. Li Z., Zhang J., Wang X. et al. Safety and risk analysis of total resection surgery for thoracic and lumbar spinal tumors: a decadal analysis of 103 cases. World J Surg Oncol 2024;22(1):275. DOI: 10.1186/s12957-024-03564-6.
16. Ырысов К.Б., Жообасарова Д.Ж., Ыдырысов И.Т. и др. Хирургическое лечение метастатических поражений позвоночника методом комплексной вертебрэктомии. Научное обозрение. Медицинские науки 2024;4:15-9. DOI: 10.17513/srms.1410.
17. Jeon J.W., Kang K.W., Kim W.K. et al. Cervical spine reconstruction after total vertebrectomy using customized three-dimensional-printed implants in dogs. J Vet Sci 2023;25(1):e2. DOI: 10.4142/jvs.23241.
18. Yoder H.R., MacRae M.R., Snead O.M. et al. Case report: corpectomy and iliac crest bone autograft as treatment for a vertebral plasma cell tumor in a dachshund dog. Front Vet Sci 2023;10:1281063. DOI: 10.3389/fvets.2023.1281063.
19. Liptak J.M., Veytsman S., Kerr S. et al. Multiple segment total en bloc vertebrectomy and chest wall resection in a dog with an invasive myxosarcoma. Vet Record Case Rep 2020;8(2):e001033. DOI: 10.1136/vetreccr-2019-001033.
20. Griffin M.A., Mastorakis A., Wustefeld-Janssens et al. Outcomes in dogs undergoing surgical stabilization and non-stereotactic radiation therapy for axial and appendicular bone tumors. Front Vet Sci 2024;11;10:1283728. DOI: 10.3389/fvets.2023.1283728.
21. Xu H., Li Y., Wang L. et al. A systematic review of the efficacy and clinical safety profile of patient-specific and off-the-shelf devices in 3D-printed spine surgery. Eur Spine J 2023;32(5):1832-44. DOI: 10.1007/s00586-023-07642-3.
22. Li Z., Li Z., Zhu L. et al. The application of 3D printing technology in the reconstruction of the spine following total en bloc spondylectomy for spinal tumors: case report and literature review. J Orthop Surg Res 2024;19(1):342. DOI: 10.1186/s13018-024-04827-4.
23. Phillips B., Powers B.E., Dernell W.S. et al. Use of single-agent carboplatin as adjuvant or neoadjuvant therapy in conjunction with surgery for appendicular osteosarcoma in dogs. J Am Anim Hosp Assoc 2009;45(1):33-8. DOI: 10.5326/0450033.
24. Bergman P.J., MacEwen E.G., Kurzman I.D. et al. Amputation and carboplatin for treatment of dogs with osteosarcoma: 48 cases (1991 to 1993). J Vet Intern Med 1996;10(2):76-81. DOI: 10.1111/j.1939-1676.1996.tb02031.x.
25. Schuetze S.M., Wathen J.K., Lucas D.R. et al. SARC009: phase 2 study of dasatinib in patients with previously treated, high-grade, advanced sarcoma. Cancer 2016;15;122(6):868-74. DOI: 10.1002/cncr.29858.
26. Davis L.E., Bobele G.B., Okcu M.F. et al. A case study of personalized therapy for osteosarcoma. Pediatr Blood Cancer 2013;60(8):E68-71. DOI: 10.1002/pbc.24548.
27. Marley K., Gullaba J., Seguin B. et al. Dasatinib modulates invasive and migratory properties of canine osteosarcoma and has therapeutic potential in affected dogs. Transl Oncol 2015;8(4):231-8. DOI: 10.1016/j.tranon.2015.03.006.
28. London C.A., Gardner H.L., Rippy S. et al. Impact of toceranib/piroxicam/cyclophosphamide maintenance therapy on outcome of dogs with appendicular osteosarcoma following amputation and carboplatin chemotherapy: a multi-institutional study. PLoS One 2015;10(10):e0124889. DOI: 10.1371/journal.pone.0124889.
29. Scharf V.F., Farese J.P., Coomer A.R. et al. Effect of bevacizumab on angiogenesis and growth of canine osteosarcoma cells xenografted in athymic mice. Am J Vet Res 2013;74(5):771-8. DOI: 10.2460/ajvr.74.5.771.
Выпуск
Другие статьи выпуска
Солитарная фиброзная опухоль (СФО) – редкое новообразование мезенхимального происхождения, на долю которой приходится менее 2 % всех опухолей мягких тканей. Впервые СФО описал в 1931 г. Дж. Х. К. Керри, который обнаружил ее в плевре. Затем эта опухоль была выявлена в различных анатомических областях, включая мягкие ткани. В связи с тем, что стандартизированных методов лечения данной нозологии нет, и из-за неэффективности лучевой и химиотерапии хирургическое лечение является методом выбора. Несмотря на свою доброкачественную природу, СФО может иметь агрессивное течение и приводить к метастазированию, что требует применения комплексного подхода к лечению.
В статье представлены клинические особенности СФО, методы ее диагностики, важность хирургического лечения, обосновывается необходимость применения мультидисциплинарного подхода, а также описывается клинический случай хирургического лечения рецидива в объеме удаления опухоли с резекцией бедренных сосудов с замещением дефектов сосудистыми имплантатами.
В статье рассматривается эволюция хирургических методов лечения злокачественных опухолей костей у детей с акцентом на развитии технологий раздвижного эндопротезирования. Описан клинический случай успешного применения первого отечественного мини-инвазивного раздвижного эндопротеза у пациента с саркомой Юинга проксимального отдела бедренной кости. Проанализированы преимущества конструкции отечественного имплантата и перспективы его внедрения в условиях импортозамещения.
Введение. Синовиальная саркома (СС) представляет собой редкую и агрессивную злокачественную опухоль мягких тканей, на долю которой приходится примерно 4 % всех сарком мягких тканей. Хотя СС может возникать в любом возрасте, в основном она встречается у подростков и молодых людей. У детей СС развивается относительно редко, но характеризуется агрессивным течением и высокой частотой метастазирования, что делает ее серьезной проблемой в педиатрической онкологии.
Цель исследования – сравнить результаты 3 протоколов лечения пациентов детского возраста с CC (Научноисследовательского института детской онкологии и гематологии им. Л. А. Дурнова Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина, Детской онкологической группы (Children’s Oncology Group, COG) и CWS-2009).
Материалы и методы. Проанализированы результаты лечения детей с СС мягких тканей (n = 103), проведенного с 1999 по 2024 г. в Научно-исследовательском институте детской онкологии и гематологии им. Л. А. Дурнова Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина по 3 протоколам – этого института, COG и CWS-2009.
Результаты. Лучшие показатели общей выживаемости были получены при использовании протоколов COG и CWS-2009, с минимальными различиями при коротких курсах полихимиотерапии. При локализованной стадии заболевания у пациентов, получавших лечение по этим протоколам, удалось достичь 100 % общей выживаемости. При радикальном хирургическом лечении в лучевой терапии необходимости не возникло.
Заключение. Согласно полученным данным при лечении локализованной СС по протоколам COG и CWS-2009 общая выживаемость достигает 100 %. Улучшение показателей 2-летней общей выживаемости у пациентов с диссеминированной СС при использовании протокола CWS-2009 связано, скорее всего, с добавлением метрономной терапии. Для уменьшения гематологической токсичности и оптимизации проведения курсов полихимиотерапии без увеличения интервала между ее курсами можно использовать гемопоэтическую поддержку на этапе консолидации.
Введение. Агрессивные гемангиомы позвоночника III стадии по классификации Enneking характеризуются экстраоссальным ростом и часто приводят к стенозу позвоночного канала и неврологическому дефициту. Стандартная чрескожная вертебропластика при этом противопоказана из-за высокого риска развития неврологических осложнений. Предпочтительной тактикой лечения агрессивных гемангиом позвоночника с неврологической симптоматикой является декомпрессия позвоночного канала с последующей открытой контролируемой вертебропластикой.
Цель исследования – определение оптимальной тактики лечения гемангиом III стадии по классификации Enneking со стенозом позвоночного канала.
Материалы и методы. Проведен ретроспективный анализ данных 32 пациентов (средний возраст – 44,5 года) с агрессивными гемангиомами, осложненными стенозом позвоночного канала и неврологическим дефицитом (классы A–D по шкале Frankel). Всем пациентам выполнено однотипное хирургическое вмешательство, включавшее дорсальный доступ, транспедикулярную фиксацию, ламинэктомию, открытую вертебропластику костным цементом и удаление мягкотканного компонента опухоли.
Результаты. Хирургическое лечение привело к значительному улучшению неврологического статуса у большинства пациентов. Показатель болевого синдрома через 6 мес после операции снизился с 7,1 до 1,7 балла по визуальной аналоговой шкале. Средний объем интраоперационной кровопотери составил 854 мл. У 3 пациентов отмечен рецидив опухоли, связанный с недостаточным объемом введенного цемента (<50 %). Потенциал для полного восстановления в значительной степени определялся своевременностью проведенного вмешательства: наилучшие результаты наблюдались у больных с меньшей продолжительностью синдрома компрессии спинного мозга и до формирования необратимых миелопатических изменений.
Заключение. Декомпрессивно-стабилизирующее вмешательство с открытой вертебропластикой является эффективным методом лечения агрессивных гемангиом со стенозом, позволяющим добиться значительного улучшения неврологического статуса и купирования болевого синдрома. Ключевыми факторами успеха являются адекватное заполнение тела позвонка цементом для окклюзии кровотока и обязательное удаление экстраоссального компонента опухоли для предотвращения развития рецидива.
Для лечения опухолевого поражения грудной стенки часто используется хирургический метод. При таких операциях неизбежно возникает дефект с нарушением каркаса и биомеханики грудной клетки с последующей дисфункцией ее органов. Несмотря на совершенствование хирургической техники, включая использование современных имплантатов, реконструкция обширных дефектов грудной клетки, особенно зоны апертур, независимо от этиологии, остается сложной задачей.
В статье представлены основные проблемы замещения дефектов верхней и нижней апертур каркаса грудной клетки при опухолевой патологии. Представлены клинические наблюдения обширных резекцией грудной стенки с одномоментной реконструкцией сверхэластичными петельчатыми модулями из никелида титана.
Синовиальная саркома является одной из наиболее агрессивных сарком мягких тканей с высоким риском раннего метастазирования. В обзоре систематизированы данные за 2015–2025 гг. о роли опухолевого микроокружения и микроРНК в формировании метастатического потенциала у детей и взрослых с данной патологией. Показано, что преобладание макрофагов М2, низкая инфильтрация CD8+-Т-клеток и активация осей рецептор программируемой клеточной гибели 1 (PD-1)/лиганд рецептора программируемой клеточной гибели 1 (PD-L1) и CD47–SIRPα создают иммуносупрессивную нишу, способствующую диссеминации опухоли. Дерегулированные микроРНК, включая тканевые, циркулирующие и экзосомные микроРНК, усиливают ангиогенез, эпителиально-мезенхимальный переход и модулируют иммунный ответ. Эти факторы формируют основу новых прогностических моделей и терапевтических стратегий, в том числе иммунотерапию и анти-микроРНК-подходы.
Введение. При неорганных забрюшинных саркомах с инвазией в магистральные сосуды выполнение обширных мультивисцеральных резекций с реконструкций сосудов является технической необходимостью. Несмотря на успехи онкососудистой хирургии, аспекты планирования и выполнения таких хирургических вмешательств остаются недостаточно изученными.
Цель исследования – ретроспективный анализ и обобщение собственного опыта выполнения сосудистых реконструкций при неорганных забрюшинных саркомах.
Материалы и методы. В исследование вошли 80 пациентов (медиана возраста – 52,5 года, 65 % мужчин, 35 % женщин), которым выполнены 88 хирургических вмешательств по поводу первичных (35 (39,8 %) случаев) и рецидивных (53 (30,2 %) случая) опухолей. Дооперационное планирование основывалось на данных клинического обследования, методов визуализации и морфологической верификации с последующим мультидисциплинарным обсуждением. В 44,3 % случаев выявлены липосаркомы, в 22,7 % – лейомиосаркомы. Сосудистая инвазия классифицировалась по системе M. H. Schwarzbach и соавт. (2006). Инвазия I типа наблюдалась у 15,9 % пациентов, II типа – у 45,5 %, III типа – у 39,6 %. Оценивались эффективность дооперационного планирования, непосредственные и отдаленные онкологические и ангиохирургические результаты.
Результаты. Методы дооперационной диагностики характеризовались высокой чувствительностью, но умеренной специфичностью: 94,7 и 68,6 % соответственно (площадь под кривой (AUC) = 0,712 (95 % доверительный интервал 0,698–0,811). В 96,6 % случаев выполнены сосудистые реконструкции в виде протезирования (57 случаев), пластики (16 случаев) или сосудистого шва (12 случаев), при этом в группе артериальной инвазии преобладало протезирование (83,7 % случаев). При операции на целевых сосудах была достигнута резекция R0. Радикальная резекция (R0) по краям опухолевого узла подтверждена в 79 (89,8 %) случаях. В отдаленном периоде наблюдения специфические сосудистые осложнения (тромбоз, окклюзия) зарегистрированы у 10 (12,05 %) пациентов. Отдаленные результаты лечения прослежены у 69 (86,25 %) больных. Сроки наблюдения составили от 3 до 92 мес (медиана – 23 мес). Локальный рецидив развился у 18,8 % пациентов после резекции R0 и у 85,7% после резекции R1/R2. Прогрессия опухолевого процесса верифицирована у 24 (39,3 %) пациентов.
Заключение. Мультивисцеральные резекции с реконструкцией магистральных сосудов при неорганных забрюшинных саркомах улучшают показатели выживаемости и снижают частоту развития локальных рецидивов. Планирование и выполнение таких хирургических вмешательств требуют мультидисциплинарного подхода. Несмотря на получение обнадеживающих результатов, ряд фундаментальных аспектов проблемы остается нерешенным и требует дальнейшего изучения.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- АБВ-Пресс
- Регион
- Россия, Москва
- Почтовый адрес
- 115522, г. Москва, а/я 136
- Юр. адрес
- 115201, г Москва, р-н Нагатино-Садовники, Старокаширское шоссе, д 2 к 2, помещ I ком 6А, 6А
- ФИО
- Наумов Леонид Маркович (ГЕНЕРАЛЬНЫЙ ДИРЕКТОР)
- E-mail адрес
- info@abvpress.ru
- Контактный телефон
- +7 (499) 9299619
- Сайт
- https://abvpress.ru/