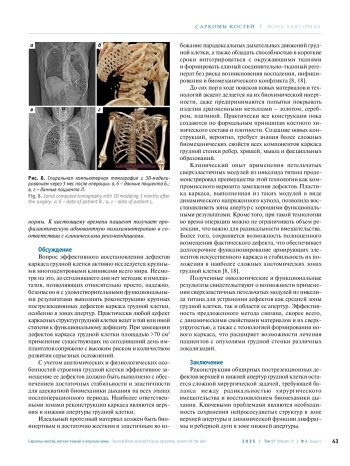
Для лечения опухолевого поражения грудной стенки часто используется хирургический метод. При таких операциях неизбежно возникает дефект с нарушением каркаса и биомеханики грудной клетки с последующей дисфункцией ее органов. Несмотря на совершенствование хирургической техники, включая использование современных имплантатов, реконструкция обширных дефектов грудной клетки, особенно зоны апертур, независимо от этиологии, остается сложной задачей.
В статье представлены основные проблемы замещения дефектов верхней и нижней апертур каркаса грудной клетки при опухолевой патологии. Представлены клинические наблюдения обширных резекцией грудной стенки с одномоментной реконструкцией сверхэластичными петельчатыми модулями из никелида титана.
Идентификаторы и классификаторы
Новообразования грудной стенки представляют собой доброкачественные и злокачественные опухоли, метастазы, инвазию опухоли в соседние органы и ткани, а также опухолеподобные заболевания грудины и ребер. Первичные злокачественные новообразования грудной стенки встречаются редко и составляют лишь 1–2 % всех опухолей и не более 5 % опухолей, локализующихся в грудном отделе [1, 2]. Как первичные, так и вторичные процессы зачастую характеризуются инвазивным ростом, сопровождаются выраженным болевым синдромом, а нередко и кровотечением, что приносит страдания больным и требует комбинированного лечения. Несмотря на достижения в терапии злокачественных опухолей грудной стенки, хирургическому вмешательству как лечебной опции попрежнему отводится ключевая роль [3].
Список литературы
1. Состояние онкологической помощи населению России в 2020 году. Под ред. А.Д. Каприна, В.В. Старинского, А.О. Шахзадовой. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 239 c.
2. Sung H., Ferlay J., Siegel R.L. et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021;71(3):209-49. DOI: 10.3322/caac.21660.
3. Wang L., Yan X., Zhao J. et al. Expert consensus on resection of chest wall tumors and chest wall reconstruction. Transl Lung Cancer Res 2021;10(11):4057-83. DOI: 10.21037/tlcr-21-935.
4. Bao T.H., Bains M.S., Shahzad F. et al. Canyons and volcanoes: the effects of radiation on the chest wall. Ann Thorac Surg 2021;112(6):e415-e418. DOI: 10.1016/j.athoracsur.2021.03.003.
5. Marulli G., Duranti L., Cardillo G. et al. Primary chest wall chondrosarcomas: results of surgical resection and analysis of prognostic factors. Eur J Cardiothora Surg 2014;45(6):e194-201. DOI: 10.1093/ejcts/ezu095.
6. Gamboa A.C., Gronchi A., Cardona K. Soft-tissue sarcoma in adults: an update on the current state of histiotype-specific management in an era of personalized medicine. CA Cancer J Clin 2020;70(3):200-29. DOI: 10.3322/caac.21605.
7. Соболевский В.А., Диков Ю.Ю., Межецкий Э.П. Клинический пример реконструкции жесткого каркаса грудной стенки с помощью системы Synthes Matrix RIB у больного массивной хондросаркомой. Саркомы костей, мягких тканей и опухоли кожи 2016;3:7-10.
8. Хакимов Х. И., Анисеня И.И., Топольницкий Е.Б. Пластика обширного дефекта грудной стенки с восстановлением реберной дуги сверхэластичными каркасными 3D-модулями после мультивисцеральной резекции при рецидивной саркоме. Онкология. Журнал им. П.А. Герцена 2023;12(5):58-64. DOI: 10.17116/onkolog20231205158.
9. Wang L., Huang L., Li X. et al. Three-dimensional printing PEEK implant: a novel choice for the reconstruction of chest wall defect. Ann Thorac Surg 2019;107(3):921-8. DOI: 10.1016/j.athoracsur.2018.09.044.
10. Scarnecchia E., Liparulo V., Capozzi R. et al. Chest wall resection and reconstruction for tumors: analysis of oncological and functional outcome. J Thorac Dis 2018;10(Suppl 16):S1855-63. DOI: 10.21037/jtd.2018.05.191.
11. Муртазина А.Ф., Никитин С.С., Наумов Е.С. Синдром верхней апертуры грудной клетки: клинические и диагностические особенности. Нервно-мышечные болезни 2017;7(7):10-9. DOI: 10.17650/2222-8721-2017-7-4-10-19.
12. Stefan S.-D., Stephan K., Jan C.K. et al. Combined disruption of the thoracic spine and costal arch fracture: an indicator of a severe chest trauma. Diagnostics (Basel) 2022;12(9):2206. DOI: 10.3390/diagnostics12092206.
13. Межецкий Э.П., Соболевский В.А. Торакоабдоминальные грыжи после резекции грудной стенки, методы профилак- тики. Саркомы костей, мягких тканей и опухолей кожи 2019;11(4):25-31.
14. Greaber G.M., Nazim M. The anatomy of the ribs and the sternum and their relationship to chest wall structure and function. Thorac Surg Clin 2007;17:473-89. DOI: 10.1016/j.thorsurg.2006.12.010.
15. Lampridis S., Minervini F., Scarci M. Management of complications after chest wall resection and reconstruction: a narrative review. J Thorac Dis 2024;16(1):737-49. DOI: 10.21037/jtd-23-621.
16. Wen X., Gao S., Feng J. et al. Chest-wall reconstruction with a customized titanium-alloy prosthesis fabricated by 3D printing and rapid prototyping. J Cardiothoracic Surg 2018;13(1):4. DOI: 10.1186/s13019-017-0692-3.
17. Aragón J., Pérez Méndez I. Dynamic 3D printed titanium copy prosthesis: a novel design for large chest wall resection and reconstruction. J Thorac Dis 2016;8:E385-9. DOI: 10.21037/jtd.2016.03.94.
18. Гюнтер В.Э., Ходоренко В.Н., Ясенчук Ю.Ф. и др. Никелид титана: медицинский материал нового поколения. Томск: издательство «МИЦ», 2006. 295 с.
Выпуск
Другие статьи выпуска
Солитарная фиброзная опухоль (СФО) – редкое новообразование мезенхимального происхождения, на долю которой приходится менее 2 % всех опухолей мягких тканей. Впервые СФО описал в 1931 г. Дж. Х. К. Керри, который обнаружил ее в плевре. Затем эта опухоль была выявлена в различных анатомических областях, включая мягкие ткани. В связи с тем, что стандартизированных методов лечения данной нозологии нет, и из-за неэффективности лучевой и химиотерапии хирургическое лечение является методом выбора. Несмотря на свою доброкачественную природу, СФО может иметь агрессивное течение и приводить к метастазированию, что требует применения комплексного подхода к лечению.
В статье представлены клинические особенности СФО, методы ее диагностики, важность хирургического лечения, обосновывается необходимость применения мультидисциплинарного подхода, а также описывается клинический случай хирургического лечения рецидива в объеме удаления опухоли с резекцией бедренных сосудов с замещением дефектов сосудистыми имплантатами.
В статье рассматривается эволюция хирургических методов лечения злокачественных опухолей костей у детей с акцентом на развитии технологий раздвижного эндопротезирования. Описан клинический случай успешного применения первого отечественного мини-инвазивного раздвижного эндопротеза у пациента с саркомой Юинга проксимального отдела бедренной кости. Проанализированы преимущества конструкции отечественного имплантата и перспективы его внедрения в условиях импортозамещения.
Остеосаркома – наиболее распространенная первичная опухоль костей у собак. В 15–25 % случаев она локализуется в осевом скелете. Поражение позвонков наблюдается реже и составляет менее 5 % случаев.
В статье представлено описание комплексного лечения остеосаркомы V поясничного позвонка у 7-летней собаки. Диагностические мероприятия включали компьютерную томографию, магнитно-резонансную томографию и открытую биопсию. Проведены предоперационная химиотерапия карбоплатином, циторедуктивное хирургическое вмешательство с применением индивидуальной аддитивно изготовленной пластины из пористого титана и последующими лучевой, химио- (карбоплатин, доксорубицин, доцетаксел) и таргетной (дазатиниб, тоцераниб, бевацизумаб) терапией. Удовлетворительный уровень жизни составил 311 дней, общая выживаемость – 400 дней. Представленный клинический случай демонстрирует высокую эффективность мультидисциплинарного подхода к лечению остеосаркомы позвонка у собаки.
Введение. Синовиальная саркома (СС) представляет собой редкую и агрессивную злокачественную опухоль мягких тканей, на долю которой приходится примерно 4 % всех сарком мягких тканей. Хотя СС может возникать в любом возрасте, в основном она встречается у подростков и молодых людей. У детей СС развивается относительно редко, но характеризуется агрессивным течением и высокой частотой метастазирования, что делает ее серьезной проблемой в педиатрической онкологии.
Цель исследования – сравнить результаты 3 протоколов лечения пациентов детского возраста с CC (Научноисследовательского института детской онкологии и гематологии им. Л. А. Дурнова Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина, Детской онкологической группы (Children’s Oncology Group, COG) и CWS-2009).
Материалы и методы. Проанализированы результаты лечения детей с СС мягких тканей (n = 103), проведенного с 1999 по 2024 г. в Научно-исследовательском институте детской онкологии и гематологии им. Л. А. Дурнова Национального медицинского исследовательского центра онкологии им. Н. Н. Блохина по 3 протоколам – этого института, COG и CWS-2009.
Результаты. Лучшие показатели общей выживаемости были получены при использовании протоколов COG и CWS-2009, с минимальными различиями при коротких курсах полихимиотерапии. При локализованной стадии заболевания у пациентов, получавших лечение по этим протоколам, удалось достичь 100 % общей выживаемости. При радикальном хирургическом лечении в лучевой терапии необходимости не возникло.
Заключение. Согласно полученным данным при лечении локализованной СС по протоколам COG и CWS-2009 общая выживаемость достигает 100 %. Улучшение показателей 2-летней общей выживаемости у пациентов с диссеминированной СС при использовании протокола CWS-2009 связано, скорее всего, с добавлением метрономной терапии. Для уменьшения гематологической токсичности и оптимизации проведения курсов полихимиотерапии без увеличения интервала между ее курсами можно использовать гемопоэтическую поддержку на этапе консолидации.
Введение. Агрессивные гемангиомы позвоночника III стадии по классификации Enneking характеризуются экстраоссальным ростом и часто приводят к стенозу позвоночного канала и неврологическому дефициту. Стандартная чрескожная вертебропластика при этом противопоказана из-за высокого риска развития неврологических осложнений. Предпочтительной тактикой лечения агрессивных гемангиом позвоночника с неврологической симптоматикой является декомпрессия позвоночного канала с последующей открытой контролируемой вертебропластикой.
Цель исследования – определение оптимальной тактики лечения гемангиом III стадии по классификации Enneking со стенозом позвоночного канала.
Материалы и методы. Проведен ретроспективный анализ данных 32 пациентов (средний возраст – 44,5 года) с агрессивными гемангиомами, осложненными стенозом позвоночного канала и неврологическим дефицитом (классы A–D по шкале Frankel). Всем пациентам выполнено однотипное хирургическое вмешательство, включавшее дорсальный доступ, транспедикулярную фиксацию, ламинэктомию, открытую вертебропластику костным цементом и удаление мягкотканного компонента опухоли.
Результаты. Хирургическое лечение привело к значительному улучшению неврологического статуса у большинства пациентов. Показатель болевого синдрома через 6 мес после операции снизился с 7,1 до 1,7 балла по визуальной аналоговой шкале. Средний объем интраоперационной кровопотери составил 854 мл. У 3 пациентов отмечен рецидив опухоли, связанный с недостаточным объемом введенного цемента (<50 %). Потенциал для полного восстановления в значительной степени определялся своевременностью проведенного вмешательства: наилучшие результаты наблюдались у больных с меньшей продолжительностью синдрома компрессии спинного мозга и до формирования необратимых миелопатических изменений.
Заключение. Декомпрессивно-стабилизирующее вмешательство с открытой вертебропластикой является эффективным методом лечения агрессивных гемангиом со стенозом, позволяющим добиться значительного улучшения неврологического статуса и купирования болевого синдрома. Ключевыми факторами успеха являются адекватное заполнение тела позвонка цементом для окклюзии кровотока и обязательное удаление экстраоссального компонента опухоли для предотвращения развития рецидива.
Синовиальная саркома является одной из наиболее агрессивных сарком мягких тканей с высоким риском раннего метастазирования. В обзоре систематизированы данные за 2015–2025 гг. о роли опухолевого микроокружения и микроРНК в формировании метастатического потенциала у детей и взрослых с данной патологией. Показано, что преобладание макрофагов М2, низкая инфильтрация CD8+-Т-клеток и активация осей рецептор программируемой клеточной гибели 1 (PD-1)/лиганд рецептора программируемой клеточной гибели 1 (PD-L1) и CD47–SIRPα создают иммуносупрессивную нишу, способствующую диссеминации опухоли. Дерегулированные микроРНК, включая тканевые, циркулирующие и экзосомные микроРНК, усиливают ангиогенез, эпителиально-мезенхимальный переход и модулируют иммунный ответ. Эти факторы формируют основу новых прогностических моделей и терапевтических стратегий, в том числе иммунотерапию и анти-микроРНК-подходы.
Введение. При неорганных забрюшинных саркомах с инвазией в магистральные сосуды выполнение обширных мультивисцеральных резекций с реконструкций сосудов является технической необходимостью. Несмотря на успехи онкососудистой хирургии, аспекты планирования и выполнения таких хирургических вмешательств остаются недостаточно изученными.
Цель исследования – ретроспективный анализ и обобщение собственного опыта выполнения сосудистых реконструкций при неорганных забрюшинных саркомах.
Материалы и методы. В исследование вошли 80 пациентов (медиана возраста – 52,5 года, 65 % мужчин, 35 % женщин), которым выполнены 88 хирургических вмешательств по поводу первичных (35 (39,8 %) случаев) и рецидивных (53 (30,2 %) случая) опухолей. Дооперационное планирование основывалось на данных клинического обследования, методов визуализации и морфологической верификации с последующим мультидисциплинарным обсуждением. В 44,3 % случаев выявлены липосаркомы, в 22,7 % – лейомиосаркомы. Сосудистая инвазия классифицировалась по системе M. H. Schwarzbach и соавт. (2006). Инвазия I типа наблюдалась у 15,9 % пациентов, II типа – у 45,5 %, III типа – у 39,6 %. Оценивались эффективность дооперационного планирования, непосредственные и отдаленные онкологические и ангиохирургические результаты.
Результаты. Методы дооперационной диагностики характеризовались высокой чувствительностью, но умеренной специфичностью: 94,7 и 68,6 % соответственно (площадь под кривой (AUC) = 0,712 (95 % доверительный интервал 0,698–0,811). В 96,6 % случаев выполнены сосудистые реконструкции в виде протезирования (57 случаев), пластики (16 случаев) или сосудистого шва (12 случаев), при этом в группе артериальной инвазии преобладало протезирование (83,7 % случаев). При операции на целевых сосудах была достигнута резекция R0. Радикальная резекция (R0) по краям опухолевого узла подтверждена в 79 (89,8 %) случаях. В отдаленном периоде наблюдения специфические сосудистые осложнения (тромбоз, окклюзия) зарегистрированы у 10 (12,05 %) пациентов. Отдаленные результаты лечения прослежены у 69 (86,25 %) больных. Сроки наблюдения составили от 3 до 92 мес (медиана – 23 мес). Локальный рецидив развился у 18,8 % пациентов после резекции R0 и у 85,7% после резекции R1/R2. Прогрессия опухолевого процесса верифицирована у 24 (39,3 %) пациентов.
Заключение. Мультивисцеральные резекции с реконструкцией магистральных сосудов при неорганных забрюшинных саркомах улучшают показатели выживаемости и снижают частоту развития локальных рецидивов. Планирование и выполнение таких хирургических вмешательств требуют мультидисциплинарного подхода. Несмотря на получение обнадеживающих результатов, ряд фундаментальных аспектов проблемы остается нерешенным и требует дальнейшего изучения.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- АБВ-Пресс
- Регион
- Россия, Москва
- Почтовый адрес
- 115522, г. Москва, а/я 136
- Юр. адрес
- 115201, г Москва, р-н Нагатино-Садовники, Старокаширское шоссе, д 2 к 2, помещ I ком 6А, 6А
- ФИО
- Наумов Леонид Маркович (ГЕНЕРАЛЬНЫЙ ДИРЕКТОР)
- E-mail адрес
- info@abvpress.ru
- Контактный телефон
- +7 (499) 9299619
- Сайт
- https://abvpress.ru/