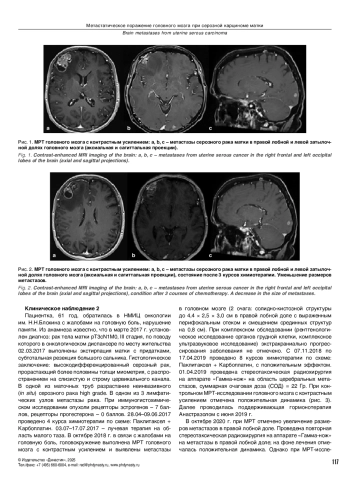
Метастатическое поражение головного мозга, источником которого является рак эндометрия, встречается редко. Представлены два случая лечения пациенток с серозной аденокарциномой матки с метастатическим поражением головного мозга, которым проводилось лечение с включением хирургического этапа, лучевой терапии и противоопухолевой лекарственной терапии и противоопухолевой лекарственной терапии в монорежиме. На фоне лечения достигнут положительный результат. Также проанализированы результаты лечения пациенток с метастазами серозной аденокарциномы эндометрия в головном мозге на основании немногочисленных публикаций, поиск которых осуществлялся в базах MEDLINE, PubMed, Scopus, Googleshсolar.
Идентификаторы и классификаторы
Среди онкогинекологических заболеваний рак эндометрия (РЭ) занимает ведущее место в экономически развитых странах, а в России – первое место в структуре заболеваемости женского населения [1–8]. Рак эндометрия является заболеванием с относительно благоприятным прогнозом в целом [9–11].
Список литературы
1. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2015. CA Cancer J Clin. 2015 Jan-Feb;65(1):5-29. DOI: 10.3322/caac.21254
2. Globocan 2012: Estimated Cancer Incidence, Mortality and Prevalence Worldwide in 2012.
3. Каприн АД, Старинский ВВ, Шахзадова АО. Злокачественные новообразования в России в 2021 году (заболеваемость и смертность). М., 2022.
4. Chhikara BS, Parang K. Global Cancer Statistics 2022: The Trends Projection Analysis. Chem Biol Lettю 2023; 10 (1): 451.
5. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, et al. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021 May;71(3): 209-249. DOI: 10.3322/caac.21660
6. Wei W, Zeng H, Zheng R, Zhang S, An L, Chen R, et al. Cancer registration in China and its role in cancer prevention and control. Lancet Oncol. 2020 Jul;21(7): e342-e349. DOI: 10.1016/S1470-2045(20)30073-5
7. Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024 May-Jun;74(3):229-263. DOI: 10.3322/caac.21834
8. Ferlay J, Colombet M, Soerjomataram I, Parkin DM, Pineros M, Znaor A, et al. Cancer statistics for the year 2020: An overview.Int J Cancer. 2021 Apr 5. DOI: 10.1002/ijc.33588
9. Boruta DM 2nd, Gehrig PA, Fader AN, Olawaiye AB. Management of women with uterine papillary serous cancer: a Society of Gynecologic Oncology (SGO) review. Gynecol Oncol. 2009 Oct;115(1):142-153. DOI: 10.1016/j.ygyno.2009.06.011
10. Давыдов АИ, Грибова МР, Дорфман МФ, Чилова РА, Лебедев ВА, Машина МА. Аномальные маточные кровотечения. Анализ результатов ультрасонографии по системе IETA. Вопросы гинекологии, акушерства и перинатологии. 2022;21(2):69-76. DOI: 10.20953/1726-1678-2022-2-69-76
11. Bristow RE, Asrari F, Trimble EL, Montz FJ. Extended surgical staging for uterine papillary serous carcinoma: survival outcome of locoregional (Stage I-III) disease. Gynecol Oncol. 2001 May;81(2):279-86. DOI: 10.1006/gyno.2001.6159
12. Гуторова ДС, Бреусенко ВГ, Карева ЕН, Каппушева ЛМ, Голухов ГН, Краснощок ЕВ, и др. Пролиферативные процессы эндометрия у пациенток в постменопаузе и стероидный транскриптом мононуклеаров периферической крови. Есть ли связь? Вопросы гинекологии, акушерства и перинатологии. 2025;24(1):30-37. 10.20953/ 1726-1678-2025-1-30-37. DOI: 10.20953/1726-1678-2025-1-30-37
13. Tropé C, Kristensen GB, Abeler VM. Clear-cell and papillary serous cancer: treatment options. Best Pract Res Clin Obstet Gynaecol. 2001 Jun;15(3):433-46. DOI: 10.1053/beog.2000.0187
14. Fader AN, Drake RD, O’Malley DM, Gibbons HE, Huh WK, Havrilesky LJ, et al. Uterine Papillary Serous Carcinoma (UPSC) Consortium. Platinum/taxane-based chemotherapy with or without radiation therapy favorably impacts survival outcomes in stage I uterine papillary serous carcinoma. Cancer. 2009 May 15; 115(10):2119-27. DOI: 10.1002/cncr.24247
15. Creutzberg CL, van Putten WL, Koper PC, Lybeert ML, Jobsen JJ, Warlam-Rodenhuis CC, et al. Surgery and postoperative radiotherapy versus surgery alone for patients with stage-1 endometrial carcinoma: multicentre randomised trial. PORTEC Study Group. Post Operative Radiation Therapy in Endometrial Carcinoma. Lancet. 2000 Apr 22;355(9213):1404-11. 10.1016/s0140-6736 (00)02139-5. DOI: 10.1016/s0140-6736(00)02139-5
16. Bokhman JV. Two pathogenetic types of endometrial carcinoma. Gynecol Oncol. 1983 Feb;15(1):10-7. DOI: 10.1016/0090-8258(83)90111-7
17. Давыдов АИ, Попков СА, Утишева ЕВ, Кузнецов РЭ, Макеева ДИ, Смирнова ЛЕ, и др. Хирургия как метод иммунокоррекции. Вопросы гинекологии, акушерства и перинатологии. 2022;21(1):36-42. DOI: 10.20953/1726-1678-2022-1-36-42
18. Воинов НЕ, Улитин АЮ, Лавровский ПВ, Диконенко МВ, Сафаров БИ, Скляр СС, и др. Удаление гигантского метастаза рака сигмовидной кишки в кости черепа с экстра- и интракраниальным распространением. Нейрохирургия. 2023;25(3):78-87.
19. Медведев СВ, Ткачев СИ, Москвина ЕА, Михина ЗП, Насхлеташвили ДР, Булычкин ПВ, и др. Комплексное лечение больных с метастатическим поражением головного мозга при раке молочной железы. Вопросы онкологии. 2015;61(6):965-967.
20. Москвина ЕА, Горбунова ВА, Насхлеташвили ДР, Медведев СВ, Бекяшев АХ, Белов МД. Капецитабин в сочетании с лучевой терапией при метастатическом поражении головного мозга у больных раком молочной железы. Российский онкологический журнал. 2015;20(1):13-17.
21. Насхлеташвили ДР, Банов СМ, Бекяшев АХ, Голанов АВ, Зайцев АМ, Кобяков ГЛ, и др. Метастатическое поражение центральной нервной системы. Злокачественные опухоли. 2023;13(3S2-1):148-156.
22. Банов СМ, Гуторов СЛ, Колядина ИВ, Смолин АВ, Крюков ЕВ, Голанов АВ, и др. Рак молочной железы с метастазами в головной мозг: современные возможности лечения. Вопросы онкологии. 2021;67(5):614-623. DOI: 10.37469/0507-3758-2021-67-5-614-623
23. Ветлова ЕР, Банов СМ, Голанов АВ. Метастазы колоректального рака в головной мозг. Диагностика и лечение. Онкологический журнал: лучевая диагностика, лучевая терапия. 2018;1(1):63-68.
24. Ротин ДЛ, Степанян МА, Черекаев ВА. Метастазы в головной мозг и основание черепа карцином, редко метастазирующих в ЦНС (клинико-морфологический анализ 51 наблюдения и обзор литературы). Поволжский онколо гический вестник. 2013;1:43-49.
25. Азизян РИ, Саприна ОА, Бекяшев АХ, Белов ДС, Гаспарян ТГ, Горобец ЕС, и др. Местно-распространенный рак щитовидной железы. Случай из практики. Опухоли головы и шеи. 2015;5:4:53-57.
26. Мустафина ЕА, Шевчук АС, Паяниди ЮГ, Занозина ЕА, Комаров ИГ, Жорданиа КИ. Хирургическое лечение рецидивов рака эндометрия. Онкогинекология. 2022;4(44):25-36.
27. Севян НВ, Карахан ВБ, Прозоренко ЕВ, Бекяшев АХ, Митрофанов АА. Опыт хирургического лечения церебральных метастазов опухолей органов женской репродуктивной системы: анализ 37 случаев. Вопросы нейрохирургии им. Н.Н.Бурденко. 2021;85(1):56-67. DOI: 10.17116/neiro20218501156
28. Севян НВ, Карахан ВБ, Цыбульская ЮА, Бондаренко ЮВ. Церебральные метастазы рака эндометрия. Диагностические и нейрохирургические аспекты. Опухоли женской репродуктивной системы. 2013;1-2:72-82.
29. Чернов СВ, Красильников СЭ, Рзаев ДА, Калиновский АВ, Зотов АВ, Касымов АР, и др. Преимущественная локализация и пути метастазирования в головной мозг злокачественных образований женской репродуктивной системы. Нейрохирургия. 2024;26(2):54-60. DOI: 10.17650/1683-3295-2024-26-2-54-60
30. Неродо ГА, Владимирова ЛЮ, Миташок ИС, Калабанова ЕА, Росторгуев ЭЕ. Метастатическое поражение головного мозга при онкогенитальной патологии. Акушерство и гинекология. 2018;1:96-101.
31. Piura E, Piura B. Brain metastases from endometrial carcinoma. ISRN Oncol. 2012;2012:581749. DOI: 10.5402/2012/581749
32. Moroney MR, Wheeler LJ, Corr BR. Clinical presentation of brain metastases from endometrial carcinoma: A case series. Gynecol Oncol Rep. 2019 Mar 20;28:79-83. DOI: 10.1016/j.gore.2019.03.004
33. Kim YZ, Kwon JH, Lim S. A clinical analysis of brain metastasis in gynecologic cancer: a retrospective multi-institute analysis. J Korean Med Sci. 2015 Jan; 30(1):66-73. DOI: 10.3346/jkms.2015.30.1.66
34. Batson OV. The function of the vertebral veins and their role in the spread of metastases. Ann Surg. 1940 Jul;112(1):138-49. DOI: 10.1097/00000658194007000-00016
35. Kindt GW. The pattern of location of cerebral metastatic tumors. J Neurosurg. 1964 Jan;21:54-7. DOI: 10.3171/jns.1964.21.1.0054
36. Greenberg MS: Handbook of Neurosurgery. New York: Thieme Medical Publishers. 2010;702-703.
37. Gien LT, Kwon JS, D’Souza DP, Radwan JS, Hammond JA, Sugimoto AK, et al. Brain metastases from endometrial carcinoma: a retrospective study. Gynecol Oncol. 2004 May;93(2):524-8. DOI: 10.1016/j.ygyno.2004.02.006
38. Hendrickson M, Ross J, Eifel P, Martinez A, Kempson R. Uterine papillary serous carcinoma: a highly malignant form of endometrial adenocarcinoma. Am J Surg Pathol. 1982 Mar;6(2):93-108. DOI: 10.1097/00000478-198203000-00002
39. Grice J, Ek M, Greer B, Koh WJ, Muntz HG, Cain J, et al. Uterine papillary serous carcinoma: evaluation of long-term survival in surgically staged patients. Gynecol Oncol. 1998 Apr;69(1):69-73. DOI: 10.1006/gyno.1998.4956
40. Bancher-Todesca D, Neunteufel W, Williams KE, Prainsack D, Breitenecker G, Friedlander ML, et al. Influence of postoperative treatment on survival in patients with uterine papillary serous carcinoma. Gynecol Oncol. 1998 Dec;71(3):344-7. DOI: 10.1006/gyno.1998.5202
41. Kwon J, Ackerman I, Franssen E. The role of abdominal-pelvic radiotherapy in the management of uterine papillary serous carcinoma.Int J Radiat Oncol Biol Phys. 2004 Aug 1;59(5):1439-45. DOI: 10.1016/j.ijrobp.2004.01.044
42. Zanotti KM, Belinson JL, Kennedy AW, Webster KD, Markman M. The use of paclitaxel and platinum-based chemotherapy in uterine papillary serous carcinoma. Gynecol Oncol. 1999 Aug;74(2):272-7. DOI: 10.1006/gyno.1999.5444
43. Dietrich CS 3rd, Modesitt SC, DePriest PD, Ueland FR, Wilder J, Reedy MB, et al. The efficacy of adjuvant platinum-based chemotherapy in Stage I uterine papillary serous carcinoma (UPSC). Gynecol Oncol. 2005 Dec;99(3):557-63. 10.1016/j. ygyno.2005.07.104. DOI: 10.1016/j.ygyno.2005.07.104
44. Литвинова ТМ. Рак эндометрия I стадии: рецидивы и метастазы. Вестник Витебского государственного медицинского университета. 2005;4(3):45-51.
45. Gulsen S, Terzi A. Multiple brain metastases in a patient with uterine papillary serous adenocarcinoma: Treatment options for this rarely seen metastatic brain tumor. Surg Neurol Int. 2013 Aug 28;4:111. DOI: 10.4103/2152-7806.117176
46. Crain CN, Ngwanyam R, Punch G. Rare brain metastasis with unusual characteristics in a late recurrence of stage IIIA uterine papillary serous carcinoma. BJR Case Rep. 2021 Mar 18;7(4):20200157. DOI: 10.1259/bjrcr.20200157
47. Hettrick D, Harrison Snyder M, Arkun K, Jeyapalan S, Gonzalez R, Mignano J, et al. Unusual pontine metastasis of endometrial papillary serous carcinoma: illustrative case. J Neurosurg Case Lessons. 2024 Dec 9;8(24):CASE24513. 10.3171/ CASE24513. DOI: 10.3171/CASE24513
48. Eulâlio Filho WMN, Fé TSM, Rodrigues RMM, Lima MSO, Vieira SC. Brain Metastasis in Papillary Serous Adenocarcinoma of the Endometrium. Rev Bras Ginecol Obstet. 2019 Apr;41(4):264-267. DOI: 10.1055/s-0039-1683353
49. Carson S, Hooten KG, Bunch KP. Pineal gland metastasis from uterine serous carcinoma: A case report and review of the literature. Gynecol Oncol Rep. 2021 Mar 2;36:100738. DOI: 10.1016/j.gore.2021.100738
50. Chura JC, Marushin R, Boyd A, Ghebre R, Geller MA, Argenta PA. Multimodal therapy improves survival in patients with CNS metastasis from uterine cancer: a retrospective analysis and literature review. Gynecol Oncol. 2007 Oct;107(1): 79-85. DOI: 10.1016/j.ygyno.2007.05.027
51. Осинов ИК, Голанов АВ, Банов СМ, Артеменкова АЕ, Костюченко ВВ, Далечина АВ. Стажированная радиохирургия в лечении пациентов с метастатическим поражением головного мозга. Нейрохирургия. 2021;23(1):26 37. DOI: 10.17650/16833295-2021-23-1-26-37
52. Ткачев СИ, Медведев СВ, Булычкин ПВ, Романов ДС, Михина ЗП, Яжгуно-вич ИП, и др. Стандарты лучевой терапии при метастатическом поражении головного мозга. Радиационная онкология и ядерная медицина. 2013;1: 18-27.
53. Зинькович МС, Розенко ЛЯ, Франциянц ЕМ, Шихлярова АИ, Жукова ГВ, Гусарева МА. Влияние буста на переносимость лучевой терапии у больных с метастатическим поражением головного мозга. Современные проблемы науки и образования. 2015;4:288.
54. Ткачев СИ, Медведев СВ, Булычкин ПВ, Михина ЗП, Романов ДС, Насхлеташвили ДР, и др. Лучевая терапия в комплексном лечении метастазов в головной мозг. Радиационная онкология и ядерная медицина. 2013; 2:25-29.
55. Mahmoud-Ahmed AS, Suh JH, Barnett GH, Webster KD, Belinson JL, et al. The effect of radiation therapy on brain metastases from endometrial carcinoma: a retrospective study. Gynecol Oncol. 2001 Nov;83(2):305-9. 10.1006/ gyno.2001.6384. DOI: 10.1006/gyno.2001.6384
56. Kasper E, Ippen F, Wong E, Uhlmann E, Floyd S, Mahadevan A. Stereotactic radiosurgery for brain metastasis from gynecological malignancies. Oncol Lett. 2017 Mar;13(3):1525-1528. DOI: 10.3892/ol.2017.5621
57. Monaco E 3rd, Kondziolka D, Mongia S, Niranjan A, Flickinger JC, Lunsford LD. Management of brain metastases from ovarian and endometrial carcinoma with stereotactic radiosurgery. Cancer. 2008 Nov 1;113(9):2610-4. 10.1002/ cncr.23868. DOI: 10.1002/cncr.23868
58. Wang Q, Zhang F, Gao H, Xu Y. Successful treatment of a patient with brain metastases from endometrial cancer using Niraparib: a case report. Ann Palliat Med. 2021 Jan;10(1):818-827. DOI: 10.21037/apm-21-113
59. Sun K, Mikule K, Wang Z, Poon G, Vaidyanathan A, Smith G, et al. A comparative pharmacokinetic study of PARP inhibitors demonstrates favorable properties for niraparib efficacy in preclinical tumor models. Oncotarget. 2018 Dec 14; 9(98):37080-37096. DOI: 10.18632/oncotarget.26354
60. Shelvin KB, Vincent J, Morron S, Morin M, Mammoser A, Nair N. Recurrent high grade serous endometrial cancer with brain metastases: Immunotherapy confers improved quality of life and survival. Gynecol Oncol Rep. 2024 Aug 28;55:101494. DOI: 10.1016/j.gore.2024.101494
61. Talwar S, Cohen S. Her-2 targeting in uterine papillary serous carcinoma. Gynecol Oncol Case Rep. 2012 May 8;2(3):94-6. DOI: 10.1016/j.gynor.2012.05.003
62. Santin AD, Bellone S, Van Stedum S, Bushen W, Palmieri M, Siegel ER, et al. Amplification of c-erbB2 oncogene: a major prognostic indicator in uterine serous papillary carcinoma. Cancer. 2005 Oct 1;104(7):1391-7. DOI: 10.1002/cncr.21308
63. Slomovitz BM, Broaddus RR, Burke TW, Sneige N, Soliman PT, Wu W, et al. Her-2/ neu overexpression and amplification in uterine papillary serous carcinoma. J Clin Oncol. 2004 Aug 1;22(15):3126-32. DOI: 10.1200/JCO.2004.11.154
64. Villella JA, Cohen S, Smith DH, Hibshoosh H, Hershman D. HER-2/neu overexpression in uterine papillary serous cancers and its possible therapeutic implications.Int J Gynecol Cancer. 2006 Sep-Oct;16(5):1897-902. 10.1111/ j.1525-1438.2006.00664.x. DOI: 10.1111/j.1525-1438.2006.00664.x
65. Fleming GF, Sill MW, Darcy KM, McMeekin DS, Thigpen JT, Adler LM, et al. Phase II trial of trastuzumab in women with advanced or recurrent, HER2-positive endometrial carcinoma: a Gynecologic Oncology Group study. Gynecol Oncol. 2010 Jan;116(1):15-20. DOI: 10.1016/j.ygyno.2009.09.025
66. Sierra T, Nguyen L, Mascitelli J, Kalir T, Fishman D. Brain metastasis from uterine serous carcinoma: A case report and review of literature. Gynecol Oncol Rep. 2015 Jan 15;11:34-7. DOI: 10.1016/j.gore.2015.01.001
67. Gressel GM, Lundsberg LS, Altwerger G, Katchi T, Azodi M, Schwartz PE, et al. Factors Predictive of Improved Survival in Patients With Brain Metastases From Gynecologic Cancer: A Single Institution Retrospective Study of 47 Cases and Review of the Literature.Int J Gynecol Cancer. 2015 Nov;25(9):1711-6. Erratum in: Int J Gynecol Cancer. 2016 Feb;26(2):422. Damast, Shari [added]. DOI: 10.1097/IGC.0000000000000554
68. Narasimhulu DM, Khulpateea N, Meritz K, Xu Y. Brain metastasis in two patients with stage IA papillary serous carcinoma of the uterus. Gynecol Oncol Rep. 2015 Apr 22;13:1-4. DOI: 10.1016/j.gore.2015.04.002
69. Gulsen S, Terzi A. Multiple brain metastases in a patient with uterine papillary serous adenocarcinoma: Treatment options for this rarely seen metastatic brain tumor. Surg Neurol Int. 2013 Aug 28;4:111. DOI: 10.4103/2152-7806.117176
70. Давыдов АИ, Чания КО, Асанишвили ММ, Гиоргадзе МБ, Лебедева МГ, Карпова ИО, и др. 35-килограммовая гигантская муцинозная карцинома яичника. Вопросы гинекологии, акушерства и перинатологии. 2024;23(6):135-139. DOI: 10.20953/1726-1678-2024-6-135-139
71. Ogawa K, Yoshii Y, Aoki Y, Nagai Y, Tsuchida Y, Toita T, et al. Treatment and prognosis of brain metastases from gynecological cancers. Neurol Med Chir (Tokyo). 2008 Feb;48(2):57-62; discussion 62-3. DOI: 10.2176/nmc.48.57
72. Авдинова ИВ, Чертова НА, Ульянова ЮВ, Волкова ВЛ, Пустовая ИВ, Баужадзе МВ, и др. Клиническое наблюдение вторичного поражения нижней челюсти при раке тела матки. Современные проблемы науки и образования. 2020;3. URL: https://science-education.ru/ru/article/view?id=29912.
73. Насхлеташвили ДР, Горбунова ВА, Бекяшев АХ, Бычков МБ, Прозоренко ЕВ, Митрофанов АА, и др. Противоопухолевая лекарственная терапия в алгоритме комплексного лечения метастатических опухолей головного мозга. Евразийский онкологический журнал. 2016;2:551.
74. Розенко ЛЯ, Зинькович МС, Гусарева МА. Основные позиции в лечении метастатического поражения головного мозга. Современные проблемы науки и образования. 2015;4. URL: https://science-education.ru/ru/article/view?id=20517 (In Russian).
75. Прозоренко ЕВ, Карахан ВБ, Бекяшев АХ, Алёшин ВА, Белов ДМ, Насхлеташвили ДР, и др. Хирургическая тактика при церебральных метастазах с кровоизлиянием. Опухоли головы и шеи. 2015;5(1):8-14.
Выпуск
Другие статьи выпуска
Синдром поликистозных яичников (СПКЯ) – это сложное эндокринное заболевание, распространенное среди женщин репродуктивного возраста, сопровождающееся гипотиреозом, гиперандрогенией и инсулинорезистентностью. Ген транспортера органических катионов 1 (OCT1) является одним из генов, связанных с развитием СПКЯ.
Цель. Выявить значимые связи между полиморфизмом гена OCT1 (rs628031) и предрасположенностью к СПКЯ.
Пациенты и методы. Проведен анализ однонуклеотидного полиморфизма (ОНП) гена OCT1 (rs628031) у 50 пациенток с СПКЯ и 25 здоровых женщин (контрольная группа). Ген OCT1 был амплифицирован методом полимеразной цепной реакции с использованием специфических праймеров. Генотипирование ОНП проводилось с помощью секвенирования (Macrogen, Корея); полученные данные сравнивались с эталонными последовательностями из набора NCBI.
Результаты. Возраст большинства (34,66%) пациенток с СПКЯ варьировал от 36 до 45 лет. У них были выявлены более высокие уровни всех гормонов (пролактина, тиреотропного, лютеинизирующего и фолликулостимулирующего гормонов) по сравнению с контрольной группой. Результаты показали, что полиморфизм rs628031 гена OCT1 встречался в трех генотипах как у пациенток с СПКЯ, так и у здоровых женщин: AA, AG и GG. Была продемонстрирована прямая связь между полиморфизмом rs628031 гена OCT1 и предрасположенностью к СПКЯ.
Заключение. Полиморфизм гена OCT1 (rs628031) является генетическим фактором риска развития СПКЯ у иракских женщин. Данное исследование может быть использовано для изучения генетических причин развития СПКЯ.
Социально-демографические тенденции последних лет привели к прогрессирующему повышению продолжительности жизни населения планеты. В этой связи у каждого акушера-гинеколога на приеме будет увеличиваться доля пациенток, обращающихся за медицинской помощью по поводу менопаузальных расстройств. Одним из наиболее частых расстройств постменопаузы является генитоуринарный менопаузальный синдром (ГУМС), основным морфологическим проявлением которого является урогенитальная атрофия вследствие прогрессирующей гипоэстрогении. Именно поэтому особую актуальность приобретают стратегии сохранения женского здоровья и качества жизни в долгосрочной перспективе в столь непростой период. Рассмотрены актуальные отечественные и международные рекомендации по менеджменту пациенток, страдающих ГУМС, и оценены/намечены ближайшие перспективы.
Представлено клиническое наблюдение пациентки с прервавшейся беременностью с кровотечением из частично повторно эмболизированной артериовенозной мальформации. Клиническими проявлениями на протяжении всего периода беременности у пациентки были выраженный токсикоз, рвота 2–3 раза в день, отвращение к пище, общая слабость, периодически головная боль, головокружение. Учитывая анамнез жизни, анамнез заболевания, беременность данной пациентке была противопоказана. Высококвалифицированная специализированная помощь определила благоприятный исход для матери
Рак молочной железы (РМЖ) является наиболее часто диагностируемым злокачественным заболеванием среди женщин во всем мире. Частота метастазирования после постановки диагноза РМЖ и лечения первичной опухоли составляет 20–30%. Поражение печени фиксируется в 17,8–35,0% случаев отдаленного метастазирования, определяя значимое снижение медианы общей выживаемости. Именно поэтому своевременная и корректная диагностика метастатического поражения печени с обязательным этапом в виде верификации вторичного очага имеет особо важное значение при планировании рациональной тактики лечения больных РМЖ, что напрямую влияет на прогноз заболевания. Представлено клиническое наблюдение за пациенткой с первично установленной метастатической формой РМЖ с поражением печени. Показана необходимость морфологической верификации вторичного очага на диагностическом этапе, что позволяет избежать излишнего агрессивного химиотерапевтического лечения. Акцентировано внимание на вопросах клинического течения и молекулярно-биологических особенностях внутрипротоковой карциномы in situ молочной железы, являющихся недостаточно изученными. Освещение данной темы способствует выбору оптимальной тактики ведения и лечения пациенток с установленным диагнозом метастатического рака молочной железы.
Разрыв селезенки во время беременности – редкое, но жизнеугрожающее состояние, сопровождающееся высоким риском материнской и перинатальной смертности. Представлено клиническое наблюдение травматического разрыва селезенки (1-й степени по шкале AAST) у беременной на сроке 28 нед. после дорожно-транспортного происшествия. Несмотря на наличие внутрибрюшного кровотечения (объем ~500 мл), пациентка находилась в стабильном состоянии с умеренным снижением гемоглобина (с 120 до 92 г/л). На основании данных компьютерной томографии с контрастированием и динамического наблюдения принята тактика консервативного ведения (non-operative management/NOM). Беременность пролонгирована до доношенного срока и завершилась рождением здорового ребенка (2510 г, оценка по Апгар 9–10 баллов).
Анализ литературы показывает, что большинство описанных случаев разрыва селезенки у беременных (особенно спонтанных) требуют экстренного хирургического вмешательства (спленэктомии) и часто сопровождаются неблагоприятными исходами. Данное наблюдение демонстрирует возможность органосохраняющей тактики при соблюдении критериев: стабильная гемодинамика, отсутствие прогрессирования кровотечения и возможность мультидисциплинарного контроля в условиях перинатального центра, находящегося в структуре многопрофильного стационара.
Недержание мочи у женщин является распространенной проблемой, значительно ухудшающей качество жизни. Существует два основных подтипа недержания мочи: стрессовое и ургентное, которые могут встречаться как изолированно, так и в сочетании. Эти состояния значительно ухудшают физическое, психологическое и социальное благополучие женщин. Лечение недержания мочи включает как консервативные, так и хирургические методы, однако его эффективность остается ограниченной. В последние годы внимание исследователей привлекла возможная связь микрофлоры урогенитального тракта с развитием и течением данного заболевания, но, несмотря на наличие многочисленных исследований, она остается недостаточно изученной. В статье рассматриваются общие современные сведения о характеристике урогенитальной микрофлоры у женщин с недержанием мочи, а также возможные механизмы ее воздействия на возникновение, патогенез и тяжесть заболевания. Ожидается, что дальнейшее изучение микрофлоры поможет разработать новые терапевтические подходы, направленные на улучшение диагностики и лечения недержания мочи у женщин.
Цель. Изучение диагностической и прогностической значимости индекса отношения толщины эндометрия к объему матки у девочек-подростков с аномальными маточными кровотечениями пубертатного периода (АМК ПП) и его клинической ценности в выявлении рисков гиперплазии эндометрия.
Пациенты и методы. Ретроспективное исследование, включающее данные 133 пациенток с АМК ПП в возрасте от 9 лет до 17 лет 11 мес. 28 дней. Всем пациенткам выполнено ультразвуковое исследование органов малого таза с измерением толщины эндометрия и объема матки, на основании которых рассчитывался индекс отношения толщины эндометрия к объему матки. Пороговые значения индекса и его прогностическая ценность определены с использованием ROC-анализа.
Результаты. ROC-анализ подтвердил высокую диагностическую значимость индекса отношения толщины эндометрия к объему матки в прогнозировании гиперпластических процессов эндометрия (AUC = 0,971; 95% ДИ: 0,935–1,000; p < 0,001). Установлено, что значение индекса ≥0,36 ассоциируется с высоким риском гиперплазии эндометрия и является показанием для гормонального гемостаза, диапазон 0,27–0,35 соответствует пограничному риску, при котором тактика лечения определяется индивидуально, а ≤0,26 – указывает на низкий риск, что позволяет ограничиться консервативной гемостатической терапией.
Заключение. Индекс отношения толщины эндометрия к объему матки обладает высокой прогностической значимостью и может быть использован в клинической практике для объективной оценки состояния эндометрия у пациенток с АМК ПП и обоснования тактики лечения.
Пролапс органов малого таза нередко формируется в репродуктивном периоде и носит прогрессирующий характер. При этом наиболее часто встречается десценция передней стенки влагалища, что негативным образом влияет на качество жизни молодых пациенток.
Цель. Разработать дифференцированный подход к хирургической коррекции опущения передней стенки влагалища II–III степени у пациенток молодого возраста с учетом их репродуктивных планов.
Пациенты и методы. Обследованы 125 женщин с опущением передней стенки влагалища II–III степени в возрасте от 30 до 45 лет, разделенные на 3 клинические группы в зависимости от реализованной оперативной методики: 1-я группа (n = 46) – выполнена передняя кольпоррафия собственными тканями, 2-я (n = 42) и 3-я (n = 37) группы – передняя кольпоррафия с применением одного и двух титановых сетчатых имплантатов соответственно.
Результаты. Динамический мониторинг через 1, 6, 12, 24, 36, 48 мес. после хирургического вмешательства показал отсутствие mesh-ассоциированных осложнений и значимого смещения органов малого таза и титановых эндопротезов у пациенток 2-й и 3-й групп. У 11 (23,9%) женщин 1-й группы, оперированных с использованием собственных тканей, через 24–48 мес. диагностирован рецидив заболевания.
Заключение. Хирургическую коррекцию опущения передней стенки влагалища II–III степени, в т. ч. в комбинации с десценцией шейки матки I–II степени, у пациенток репродуктивного возраста, имеющих генеративные планы, следует реализовать при помощи исключительно собственных тканей (передняя кольпорафия и кольпоперинеорафия с леваторопластикой). Комплексная трансобтураторная Timesh-гистерокольпосуспензия и Timesh-лигатурная сакроспинально-обтураторная кольпосуспензия не препятствуют наступлению и вынашиванию беременности, однако родоразрешение в подобных случаях должно осуществляться путем операции кесарева сечения.
В литературе имеются данные о влиянии билатеральной сальпингэктомии на овариальный резерв. С учетом рекомендаций репродуктологов о необходимости удаления маточных труб перед вступлением в программы вспомогательных репродуктивных технологий (ВРТ) актуальным является совершенствование методики сальпингэктомии для минимизации травмы в отношении функциональной способности яичников.
Цель. Изучить эффективность оригинальной технологии сальпингэктомии и ее влияние на репродуктивный потенциал женщин с двусторонними гидросальпинксами перед протоколом ВРТ.
Пациенты и методы. Когортное проспективное многоцентровое исследование. Изучены результаты обследования и лечения 100 инфертильных пациенток с двусторонними гидросальпинксами в возрасте от 28 до 35 лет. Выделены 2 группы пациенток. В 1-й группе (n = 50) операция выполнялась по оригинальной методике с применением предоперационного 3D-моделирования и интраоперационной хирургической навигации. Во 2-й группе (n = 50) сальпингэктомию осуществляли по стандартной методике.
Результаты. Применение оригинальной методики сальпингэктомии не повлияло на все исходные параметры овариального резерва (p > 0,05). В группе пациенток, у которых удаление маточных труб осуществлялось без предварительной идентификации сосудистых зон, сравнительный анализ показателей овариального резерва до и после операции установил его выраженное угнетение: антимюллеров гормон – 2,27 ± 0,3 и 1,95 ± 0,5 нг/мл, количество антральных фолликулов – 7,0 ± 0,6 и 5,1 ± 0,9 соответственно.
Заключение. Оригинальная методика предоперационного моделирования и хирургической навигации у пациенток с билатеральными гидросальпинксами позволяет удалить источник хронического воспаления, не нарушая кровоснабжение и репродуктивный потенциал яичников.
Цель. Изучить клинические возможности сердечно-сосудистого индекса (ССИ) для контроля состояния беременных с преэклампсией (ПЭ).
Пациенты и методы. Обследованы 264 беременные женщины. Основную группу составили 67 пациенток с ПЭ, группу сравнения – 35 беременных с хронической артериальной гипертензией (ХАГ), контрольную группу – 162 здоровые женщины с физиологическим течением гестации. Проведен анализ динамики изменений артериального давления (АД), пульса и ССИ (АД среднее / пульс). Для контроля ССИ использовали аппаратный расчет, предусмотренный в кардиотокографе DETESCO (модель: КТМ В Плюс), а также в программе Excel в рамках самоконтроля АД и пульса пациентками.
Результаты. Показатели ССИ у здоровых беременных и пациенток с ХАГ находились в пределах 0,9–1,2 и были сопоставимы на протяжении всех трех триместров беременности (р > 0,05). У женщин с ПЭ установлен значимый рост ССИ >1,3 к концу беременности в сопоставлении с контролем (р = 0,007), а также с I триместром в своей группе (р = 0,0067).
Заключение. Регулярный расчет ССИ в рамках самоконтроля АД и пульса пациентками и медперсоналом дает возможность своевременно обнаружить нарастание индекса, заподозрить приближение, дебют или прогрессирование ПЭ и принять решение о госпитализации и дальнейшей тактике ведения беременной. Использование ССИ для прогноза и контроля акушерских осложнений возможно только со второй половины беременности. Данный метод диагностики/ оценки запатентирован (патент на изобретение №2846668, патентообладатель: КГМА – филиал ФГБОУ ДПО РМАНПО Минздрава России, ЦНПНПК).
Цель. Усовершенствование диагностики истмико-цервикальной недостаточности (ИЦН) и повышение эффективности ее коррекции за счет внедрения в комплекс обследования беременных пациенток эластографии шейки матки.
Пациенты и методы. Проведено проспективное исследование, включившее 180 пациенток с подтвержденным диагнозом ИЦН. В зависимости от исходов беременности пациентки были разделены на 2 группы: в 1-ю группу (n = 44) вошли беременные, у которых наблюдалось отсутствие эффекта от коррекции ИЦН и беременность завершилась преждевременными родами, во 2-ю (n = 136) – пациентки с положительным эффектом от коррекции ИЦН, родоразрешенные в доношенный срок. Диагноз ИЦН устанавливали с помощью трансвагинальной эхографии, в качестве дополнительных методов использовали ультразвуковую эластографию, а также исследование состава биоценоза влагалища и чувствительности выделенной микрофлоры к антибактериальным препаратам.
Результаты. Основным фактором, влияющим на эффективность коррекции ИЦН, является исходная длина шейки матки. Частота преждевременных родов при критической длине шейки <15 мм составляет 54,3%, при длине шейки матки >20 мм – 13,4% (р = 0,001) (ОШ: 0,841; 0,779–0,908). Помимо длины шейки матки, важным параметром является ее жесткость по данным эластографии. «Мягкий» тип в 7,4 раза повышает риск спонтанного преждевременного родоразрешения (ОШ: 7,371; 3,083–17,619) (р = 0,001). Комбинированная оценка параметров длины и жесткости шейки матки дает более точный прогноз в отношении эффективности коррекции ИЦН. Благоприятными факторами коррекции ИЦН являются: длина шейки матки ≥20 мм вне зависимости от жесткости шейки матки и длина шейки матки 16–19 мм в сочетании со «средним» и «жестким» типами. Наиболее неблагоприятным оказалось сочетание длины шейки матки ≤15 мм с «мягким» типом.
Заключение. Внедрение эластографии в протокол цервикометрии позволяет повысить качество исследования и способствует улучшению перинатальных исходов. Механическую коррекцию ИЦН необходимо проводить пациенткам с укорочением шейки матки 20 мм. Эффективность лечения ИЦН также зависит от состояния биоценоза влагалища.
В последние годы внимание ученых всего мира направлено на изучение эффективности и исходов этанольной склеротерапии у пациенток репродуктивного возраста с эндометриомами яичников (ЭЯ). Сегодня склерозирование ЭЯ признано наиболее оптимальным методом для сохранения овариального резерва.
Цель. Анализ ближайших и отдаленных результатов этанольной склеротерапии ЭЯ у пациенток репродуктивного возраста.
Пациенты и методы. Дизайн: про- и ретроспективное одноцентровое наблюдательное исследование. В исследование включены 232 пациентки в возрасте от 18 до 39 лет (26,2 ± 2,3) с ЭЯ, которым выполнено этанольное склерозирование новообразований в период 2012–2025 гг. В зависимости от величины ЭЯ выделены 2 группы. В 1-й группе (n = 226) максимальный диаметр ЭЯ не превышал 62 мм (44,8 ± 3,9), во 2-й группе (n = 6) – варьировал от 80 до 100 мм, при этом во всех наблюдениях ЭЯ были двусторонними, а возраст пациенток составлял 22–28 лет. Ранее эти пациентки не имели беременностей. Методы инструментальной и лабораторной диагностики включали трансвагинальную эхографию с определением количества антральных фолликулов и тестирование сывороточного антимюллерова гормона. Проспективный период наблюдения составил 12 мес.
Результаты. Ни в одном из случаев не зарегистрировано достоверного уменьшения овариального резерва после склеротерапии ЭЯ. Число рецидивов в 1-й группе составило 11 (4,8%) и 19 (8,4%) через 3 и 12 мес. наблюдения соответственно. Наиболее благоприятные результату по этому показателю отмечены у пациенток с односторонними новообразованиями и цистэктомией в анамнезе: через 3 мес. наблюдения не зарегистрировано ни одного рецидива ЭЯ, а через 12 мес. их было лишь 3 (5,2%) из 56. Репродуктивные исходы склеротерапии изучили у 38 женщин 1-й группы, планировавших беременность. После противорецидивного курса гормональной терапии беременность наступила у 27 (71,1%) женщин, у 15 (55,5%) из них – в программах вспомогательных репродуктивных технологий. Случаи живорождения имели место в 25 (65,8%) из 38 наблюдений. У оставшихся 13 (34,2%) женщин беременность закончилась самопроизвольным прерыванием на сроках гестации до 5 нед. У пациенток 2-й группы потребовались 2 (n = 2) и 3 (n = 4) процедуры склеротерапии для достижения полного регресса новообразований. Беременности они не планировали.
Заключение. Этанольное склерозирование ЭЯ представляет оптимальный метод лечения пациенток репродуктивного возраста, особенно со сниженным овариальным резервом, так как не оказывает повреждающего действия на фолликулярный аппарат. Рецидивы ЭЯ после склеротерапии следует расценивать не в качестве классической экзацербации, а как фактор потенциально вероятного этапа склерозирования.
Цель. Установить ключевые антенатальные и интранатальные риски, влияющие на выживаемость недоношенных детей.
Пациенты и методы. Двуцентровое ретроспективное когортное исследование. Ретроспективный анализ анамнестических данных беременных женщин с преждевременными родами (n = 1109), находившихся в родовспомогательных учреждениях в период 2021–2024 гг. Все пациенты были разделены на 3 группы: группа 1 – экстремально недоношенные (гестационный возраст (ГВ) <28 нед.); группа 2 – глубоко недоношенные (ГВ 28–31 нед. + 6 дней); группа 3 – умеренно недоношенные или поздние недоношенные (ГВ 32–36 нед. + 6 дней). Для оценки статистической значимости различий между группами использовали критерий χ2, для корректного сравнения между группами с разным числом пациентов была проведена нормализация данных. Для анализа статистически значимых различий между конкретными группами были проведены попарные сравнения с использованием критерия χ2 с поправкой Бонферрони. Все факторы, показавшие достоверные отличия в сравнительном анализе, были проанализированы в многофакторном логистическом регрессионном анализе для выявления их связи с исходом (выжил или нет).
Результаты. При анализе факторов риска летального исхода у новорожденных 1-й группы исследования результаты (χ2 = 67,0323, df = 8, р = 0,00001) показали статистическую значимость модели в целом. Было выявлено, что факторами риска, влияющих на выживаемость недоношенных детей 1-й группы, являются ГВ (р < 0,0001, OR = 2,0176, 95% CI: 1,4417–2,8236) и преэклампсия (р = 0,0494, OR = 0,4065, 95% CI: 0,1657–0,9976). Для 2-й группы наблюдения модель в целом является статистически значимой: χ2 = 42,5495, df = 8, р = 0,00001. Отмечена тенденция к значимости для показателя Апгар на 1-й минуте (р = 0,0655, OR = 2,0227, 95% CI: 0,9560–4,2798). Наличие связи между совокупностью факторов и исходом у когорты детей 3-й группы наблюдения подтверждено логистическим регрессионным анализом: χ2 = 31,7929, df = 8, р = 0,0001. Оценка по шкале Апгар на 5-й минуте оказалась статистически значимым предиктором выживаемости (р = 0,0274, OR = 9,3922, 95% CI: 1,2831–68,7486).
Заключение. Летальность недоношенных детей усиливается при наличии следующих факторов: в группе 1 – наличие у матери преэклампсии; в группа 2 – оценка по шкале Апгар на 1-й минуте; в группе 3 – оценка по шкале Апгар на 5-й минуте. Совокупность всех факторов является фактором риска летальности недоношенных детей.
Бактериальный вагиноз (БВ) ассоциирован с формированием полимикробных биопленок, играющих ключевую роль в патогенезе данного состояния и обеспечивающих устойчивость этиологических агентов к антимикробной терапии. Идентификация биопленок возможна благодаря методам прямой визуализации, однако их применение в рутинной практике ограничено. В связи с этим перспективным направлением является применение метода полимеразной цепной реакции в режиме реального времени (ПЦР-РВ) как потенциального инструмента, позволяющего выявить различия в микробном пейзаже влагалища у женщин с биопленочным и небиопленочным БВ и определить наиболее патогномоничных для биопленок представителей микроорганизмов.
Цель. Сравнить микробный состав влагалища у женщин с биопленочным и небиопленочным БВ и определить молекулярно-генетические характеристики биопленок путем сопоставления данных трансмиссионной электронной микроскопии и ПЦР-РВ.
Пациенты и методы. Проведен сравнительный анализ микробного состава влагалища у пациенток с биопленочным и небиопленочным БВ с помощью метода ПЦР-РВ. Идентификация биопленок осуществлялась методом трансмиссионной электронной микроскопии.
Результаты. При сопоставлении результатов ПЦР-РВ как до, так и после терапии у пациенток с биопленочной формой БВ выявлялось устойчивое доминирование облигатных анаэробов над бактериями рода Lactobacillus в отличие от женщин без биопленок (p ≤ 0,05). Вместе с тем сравнительный анализ пациенток после терапии выявил широкое разнообразие условно-патогенных микроорганизмов в составе биопленок и значимые количества большинства облигатных анаэробов по сравнению с небиопленочной формой БВ. Значимой молекулярно-генетической характеристикой персистенции биопленок после лечения определен комплекс Gardnerella vaginalis + Prevotella bivia + Porphyromonas spp. (AUC = 0,841; p ≤ 0,05).
Заключение. Биопленки при БВ являются устойчивым резервуаром полимикробных ассоциаций. ПЦР-РВ (тест Фемофлор®16) может рассматриваться как перспективный метод непрямой диагностики персистенции биопленок урогенитального тракта в рутинной практике у женщин с рецидивирующим течением БВ.
Цель. Определить связь между вариабельностью уровня глюкозы у беременных с гестационным сахарным диабетом (ГСД) и параметрами плода для выявления факторов, влияющих на перинатальные исходы.
Пациенты и методы. В исследовании участвовали 50 пациенток с ГСД, которым был установлен датчик непрерывного мониторинга глюкозы FreeStyle Libre 2. На сроке ≥30 нед. проводилось ультразвуковое исследование плода.
Результаты. Установлена взаимосвязь между некоторыми клинико-лабораторными показателями у беременных женщин с ГСД и вариабельностью уровней сывороточной глюкозы: отрицательная корреляция между общим билирубином и временем в целевом диапазоне (%) (R = -0,386, p = 0,049) указывает на тенденцию к снижению времени в целевом диапазоне уровня глюкозы при повышении уровня билирубина, уменьшение среднего уровня глюкозы (ммоль/л) наблюдается с увеличением роста беременной (R = -0,338 p = 0,044) и длины бедренной кости у плода (R = -0,491, p = 0,009). Корреляции между ростом беременной и расчетным уровнем гликированного гемоглобина (%) (R = -0,339, p = 0,042) и длиной бедренной кости (R = -0,503, p = 0,007) также являются значительными. Более того, наблюдается корреляция между ростом беременной и процентом вариабельности глюкозы (R = -0,438, p = 0,0322) и уровнем холестерина (R = -0,394, p = 0,046). Высокий уровень холестерина и длина бедренной кости коррелируют с увеличением случаев, когда уровень глюкозы находится ниже целевого диапазона (R = -0,583, p = 0,001 и R = -0,606, p = 0,047 соответственно).
Заключение. Имеются значимые взаимосвязи между вариабельностью уровней глюкозы и некоторыми клинико-лабораторными показателями у матери, а также ультразвуковыми параметрами плода.
Цель. Изучить прогностическое значение комплекса показателей оксидативного стресса в оценке эффективности терапии тяжелой преэклампсии (ПЭ).
Пациенты и методы. Проспективное исследование, включающее 201 беременную пациентку: 50 женщин с нормально протекающей беременностью и 151 – с диагнозом тяжелой ПЭ, Сформированы 4 группы: группа 1 (n = 71) – пациентки с отсутствием эффекта от терапии тяжелой ПЭ в течение 6–24 ч; группа 2 (n = 43) – с временным эффектом; группа 3 (n = 37) – с полным эффектом; группа 4 (n = 50, контрольная) – с нормально протекающей беременностью. Проанализированы анамнезы беременных, жалобы, данные результатов клинико-лабораторных и инструментальных методов обследования в течение беременности и при госпитализации в стационар. Проведена сравнительная оценка перинатальных исходов новорожденных. Одномоментно исследовали содержание IMA (модифицированный ишемией альбумин), антиоксидантную способность (АОС) и метаболиты оксида азота (NO) в сыворотке крови беременных женщин.
Результаты. Проведена оценка диагностической возможности маркеров оксидативного стресса, отражающих гипоксические изменения в тканях и прогнозирующих эффективность терапии тяжелой ПЭ. Статистическая значимость выявлена для IMAR (отношение IMA к концентрации сывороточного альбумина (IMA / albumin ratio), АОС и метаболитов NO (p < 0,001). С учетом взаимосвязи оксидативного стресса (ОС) и системного воспаления показатели метаболитов NO продемонстрировали наибольшую информативность.
Заключение. У пациенток с выраженными изменениями показателей ОС не отмечено положительного эффекта от проводимого лечения в связи с тем, что восстановление эндотелиальной дисфункции при значительных клеточных повреждениях невозможно. Более низкие значения всех исследуемых маркеров указывают на лучшую эффективность терапии при менее выраженном клеточном повреждении. Оптимальный подход к ведению пациенток с ПЭ подразумевает персонализированный подход, основанный на комплексном динамическом мониторинге клинических и лабораторно-инструментальных данных, а также применении дополнительных методов исследования, позволяющих оценить патогенетические механизмы, лежащие в основе заболевания.
Определение патогенеза, своевременная ранняя диагностика и адекватное лечение преэклампсии (ПЭ) позволят снизить частоту материнской и перинатальной заболеваемости и смертности.
Цель. Анализ гипотезы о влиянии белков терминальных ворсин плаценты на формирование ПЭ.
Пациенты и методы. После клинического обследования и установления диагноза выделены 6 пациенток: 3 с физиологической беременностью и 3 с тяжелой ПЭ. Возраст пациенток варьировал от 19 до 32 лет, срок беременности – от 34 до 40 нед. Все пациентки принадлежали к европеоидной расе и проживали в обычных условиях в г. Москве. У всех пациенток после родов из среднего слоя плаценты отбирали участки преимущественно с терминальными ворсинами. Белки в терминальных ворсинах плаценты определяли с помощью панорамной масс-спектрометрии.
Результаты. При ПЭ и физиологической беременности зарегистрировано 1858 общих белков. Помимо этого, при физиологической беременности и при ПЭ обнаружены 532 (28,6%) и 301 (16,2%) разных белков соответственно. В группе общих белков выявлено 76 наблюдений, в которых белки в 3 разных измерениях могли отличаться по NSAF в 2–3 раза, 39 – в 3–4 раза и 51 – >4 раз. После отсечений случайных наблюдений белков с высокой экспрессией оказалось всего 10: CSPG2, CFAH, NOS3, XPO1, PARP1, PRG2, K1C9, K1C10, NHRF1, ITA2B. При определении белокбелковых взаимодействий (PPI), ассоциированных с биологическим процессом «развитие анатомических структур» (GO:0048856) белков, идентифицированных в терминальных ворсинах плаценты при ПЭ, белок ACTB принимал наиболее активное участие.
Заключение. Выявлены белки-кандидаты, которые могут быть потенциально использованы для прогнозирования ПЭ, определения патогенеза и возможных путей ее профилактики, диагностики и своевременного лечения.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- Династия
- Регион
- Россия, Москва
- Почтовый адрес
- 117149, г. Москва, ул. Азовская, д.6, к.3, офис 8/2
- Юр. адрес
- 117149, г. Москва, вн.тер.г. Муниципальный округ Зюзино, ул. Азовская, д.6, к.3, этаж,блок 8,8/2, помещ.12
- ФИО
- Макарова Татьяна Владимировна (Директор)
- E-mail адрес
- red@phdynasty.ru
- Контактный телефон
- +7 (495) 6606004