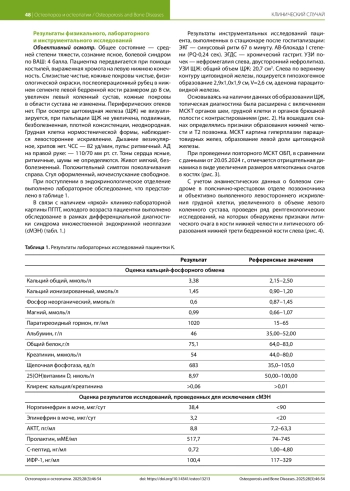
Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, характеризующееся избыточной секрецией паратгормона и приводящее к полиорганным нарушениям, снижающим качество жизни пациентов. Заболевание нередко диагностируется на этапе развития костных осложнений, например, таких как фиброзно-кистозный остеит (ФКО), из-за отсутствия рутинного скрининга кальция. Ошибочная интерпретация ФКО как неоплазии может привести к неоправданным биопсиям или хирургическим вмешательствам. Ключевыми аспектами дифференциальной диагностики являются оценка лабораторных показателей фосфорно-кальциевого обмена на этапе диагностики, анализ рентгенологических и гистологических маркеров ПГПТ. Представленный клинический случай демонстрирует, как комплексная оценка данных позволяет отличить метаболические костные поражения при ПГПТ, минимизируя ошибки в тактике лечения.
Идентификаторы и классификаторы
Первичный гиперпаратиреоз (ПГПТ) — эндокринное заболевание, характеризующееся избыточной секрецией паратиреоидного гормона (ПТГ) при верхне-нормальном или повышенном уровне кальция крови вследствие первичной патологии околощитовидных желез (ОЩЖ) [1]. Данное заболевание приводит к развитию различных полиорганных осложнений, что может существенно снизить качество жизни пациентов, вплоть до инвалидизации [1]. В 80% случаев причиной развития ПГПТ является одиночная аденома ОЩЖ, в 10–15% — гиперплазия ОЩЖ, в 5% — множественные аденомы, а рак паращитовидной железы в 1% случаев [2].
Список литературы
1. Мокрышева Н.Г., Еремкина А.К., Мирная С.С., Крупинова Ю.А., и др. Клинические рекомендации по первичному гиперпаратиреозу, краткая версия. // Проблемы Эндокринологии. - 2021. - Т.67. - №4. - С. 94-124. DOI: 10.14341/probl12801
2. Bilezikian JP. Primary hyperparathyroidism. J Clin Endocrinol Metab. 2018;103:3993-4004. DOI: 10.1210/jc.2018-01225
3. Khan AA, Hanley DA, Rizzoli R, Bollerslev J, Young JE, et al. Primary hyperparathyroidism: review and recommendations on evaluation, diagnosis, and management. A Canadian and international consensus. Osteoporos Int. 2017;28(1):1-19. DOI: 10.1007/s00198-016-3716-2
4. Makras P, Anastasilakis AD. Bone disease in primary hyperparathyroidism. Metabolism. 2018;80(11):57-65. DOI: 10.1016/j.metabol.2017.10.003
5. Bennett J, Suliburk JW, Morón FE. Osseous manifestations of primary hyperparathyroidism: imaging findings. Int J Endocrinol. 2020;2020(11):1-10. DOI: 10.1155/2020/3146535
6. Yanevskaya LG, Karonova T, Sleptsov IV, Boriskova ME, Bakhtiyarova AR, et al. Clinical phenotypes of primary hyperparathyroidism in hospitalized patients who underwent parathyroidectomy. Endocr Connect. 2021;10(2):248-255. DOI: 10.1530/EC-20-0515
7. Anastasopoulou C, Naji Rad S, Barnett MJ, Deluxe L. Osteitis Fibrosa Cystica. Treasure Island (FL); 2023 Nov 12.
8. Hamidi S, Mottard S, Berthiaume MJ, Doyon J, Bégin MJ, Bondaz L. Brown tumor of the iliac crest initially misdiagnosed as a giant cell tumor of the bone. Endocrinol Diabetes Metab Case Rep. 2020;2020:20-0029. DOI: 10.1530/EDM-20-0029
9. Clarke BL. Asymptomatic Primary Hyperparathyroidism. Front Horm Res. 2019;51:13-22. DOI: 10.1159/000491035
10. Матюшкина А.С., Горбачева А.М., Ткачук А.В., Еремкина А.К., Мокрышева Н.Г. Случай клинически агрессивного течения первичного гиперпаратиреоза, алгоритм дифференциальной диагностики. // Проблемы Эндокринологии. - 2022. - Т.68. - №6. - С.59-66. DOI: 10.14341/probl13159
11. Берченко Г.Н., Морозов А.К., Семенова Л.А., Франтов А.Р. Диагностика гигантоклеточной репаративной гранулемы костей кистей и стоп. // Вестник травматологии и ортопедии им. Н.Н. Приорова. - 2001. - Т.8. - №2. - С.87-92. DOI: 10.17816/vto98470
12. Radiomed.ru. Онкология. КCС. Гигантоклеточная опухоль. Доступ по ссылке: https://radiomed.ru/publications/13933-onkologiya-kss-gigantokletochnaya-opuhol.
13. Athanasou NA, Bansal M, Forsyth R, et al. Giant cell tumour of bone. In: Fletcher CD, Bridge JA, Hogendoorn PC, eds. WHO classification of tumours of soft tissue and bone. Lyon, France: IARC Press; 2013:321-324.
14. Eremkina AK, Pylina SV, Elfimova AR, Gorbacheva AM, Humbert L, et al. Analysis of Bone Phenotype Differences in MEN1-Related and Sporadic Primary Hyperparathyroidism Using 3D-DXA. J Clin Med. 2024;13(21):6382. DOI: 10.3390/jcm13216382
15. Misiorowski W, Czajka-Oraniec I, Kochman M, Zgliczyński W, Bilezikian JP. Osteitis fibrosa cystica-a forgotten radiological feature of primary hyperparathyroidism. Endocrine. 2017;58(2):380-385. DOI: 10.1007/s12020-017-1414-2
16. Петрушин А.Л., Нехорошкова Т.В. Проявление первичного гиперпаратиреоза со стороны костной системы. // РМЖ. - 2019. - Т.8. - №I. - С.21-26.
17. Ho LY, Wong PN, Sin HK, Wong YY, Lo KC, Chan SF, Lo MW, Lo KY, Mak SK, Wong AK. Risk factors and clinical course of hungry bone syndrome after total parathyroidectomy in dialysis patients with secondary hyperparathyroidism. BMC Nephrol. 2017;18(1):12. DOI: 10.1186/s12882-016-0421-5
18. Еремкина А.К., Сазонова Д.В., Бибик Е.Е., Шейхова А.З., Хайриева А.В., Буклемишев Ю.В., Мокрышева Н.Г. Тяжелые костные осложнения первичного гиперпаратиреоза у молодого пациента с верифицированной мутацией в гене MEN1. // Проблемы Эндокринологии. - 2022. - Т.68. - №1. - С.81-93. DOI: 10.14341/probl12864
19. Паршина Е.В., Кислый П.Н., Новокшонов К.Ю., Толкач А.Д., Черников Р.А., Карелина Ю.В. Тяжелая гипокальциемия - проблема раннего послеоперационного периода после паратиреоидэктомии по поводу вторичного гиперпаратиреоза у диализных больных. // Нефрология и диализ. -2021. - Т.23 - №3. - С. 390-400.
Выпуск
Другие статьи выпуска
Синдромы преждевременного старения — это группа ультраредких гетерогенных наследственных заболеваний, проявляющихся преимущественно в детском возрасте и характеризующихся ускоренным старением организма. Несмотря на различия патогенеза, заболевания характеризуются мультисистемными изменениями, в том числе поражением опорно-двигательного аппарата, которые представлены множественными контрактурами суставов, деформациями позвоночника и конечностей, изменениями структуры костной ткани.
Проанализированы данные обследования 6 пациентов: 5 детей (3 мальчика и 2 девочки) с детской прогерией (синдром Хатчинсона-Гилфорда) (4 пациента с классическим генотипом детской прогерии (c.1824C>T в гене LMNA) и 1 ребенок — с неклассическим (c.1968+1G>A в гене LMNA)) и одна девочка с неонатальным прогероидным синдромом (синдром Видемана-Раутенштрауха) (c.3337- 11T>C/ c.3677T>C в гене POLR3A). Диагноз был установлен в возрасте 1,9 (1,5; 4,3) года (Ме (25%; 75%)). Пациенты находились под наблюдением врача — детского эндокринолога, осматривались врачом — травматологом-ортопедом, проводились рентгенологические исследования, денситометрия поясничного отдела позвоночника. Возраст на момент первичного обследования — 6,0 (3,5; 7,2) лет, повторного — 7,6 (7,5; 9,3) года.
Костно-суставные изменения при синдроме Хатчинсона-Гилфорда были представлены контрактурами межфаланговых суставов пальцев кистей и стоп, лучезапястных, локтевых, тазобедренных, коленных и голеностопных суставов, плоско-вальгусными стопами; у пациента с неклассическим генотипом детской прогерии данные изменения диагностированы при первом обследовании в 1 год 6 мес, что подтверждает тяжелое течение заболевания при данном генотипе. У двух пациентов старшего возраста (7 лет 5 мес и 9 лет 10 мес) также диагностированы coxa valga с двух сторон с развитием асептического некроза головки бедренной кости и закрытого вывиха левой бедренной кости. При неонатальном прогероидном синдроме поражения опорно-двигательного аппарата проявлялись в виде множественных контрактур больших и малых суставов и деформацией позвоночника. Костный возраст либо соответствовал хронологическому, либо отставал на 18 (15; 26) мес. У всех пациентов, по данным денситометрии, был диагностирован остеопороз (Z-критерий: -3,4 (-3,0; -3,8)); переломов не зафиксировано.
Выявленные изменения костной ткани и опорно-двигательного аппарата у наших пациентов соответствуют особенностям, описанным в мировой литературе у пациентов с синдромами Хатчинсона-Гилфорда и Видемана-Раутенштрауха. Схожесть патологических изменений свидетельствует о схожести фенотипов заболеваний, входящих в группу синдромов преждевременного старения.
Бисфосфонаты, традиционно применяемые для лечения остеопороза, демонстрируют широкий спектр плейотропных эффектов, выходящих за рамки их антирезорбтивного действия на костную ткань. Настоящий обзор анализирует современные научные данные о «неантиостеопорозных» эффектах бисфосфонатов, полученные в исследованиях 2015–2024 гг. Установлено, что бисфосфонаты обладают выраженным анальгетическим действием, особенно эффективным при болевом синдроме, обусловленном костными метастазами. Противоопухолевые эффекты включают онкопротективное действие и прямое воздействие на опухолевые клетки через различные молекулярные механизмы. Кардиоваскулярные эффекты проявляются в кардиопротективном действии и влиянии на процессы сосудистой кальцификации. Показана эффективность препаратов при заболеваниях суставов, включая остеоартроз, хотя данные об эффективности при асептическом некрозе головки бедренной кости остаются противоречивыми. Перспективными направлениями являются применение в ортопедической хирургии для профилактики асептической нестабильности эндопротезов и разработка конъюгатов с антибактериальными препаратами для лечения остеомиелита. Инновационные подходы включают использование бисфосфонатов для таргетной доставки нейротрофических факторов при сенсоневральной тугоухости. Уникальность данного обзора заключается в комплексном анализе всего спектра неантиостеопорозных эффектов с акцентом на новейшие разработки и критическую оценку перспектив клинического внедрения с учетом соотношения пользы и риска.
Саркопения представляет собой ассоциированную с возрастом прогрессирующую потерю мышечной массы и мышечной силы, что приводит к снижению функциональной активности, повышению риска падений, переломов, госпитализаций и вносит существенный вклад в инвалидизацию и смертность населения старшей возрастной группы. Универсального объяснения пути развития саркопении не существует. Среди механизмов снижения мышечной массы выделяют влияние внешних (хронические заболевания, гиподинамия, прием ряда лекарственных препаратов, недостаточное употребление белка с пищей) и внутренних факторов (возрастная нейромышечная дегенерация, изменение уровня анаболических гормонов, хроническое воспаление и оксидативный стресс). Многофакторный патогенез развития саркопении объясняет отсутствие общепринятых инструментов диагностики данного состояния. Цель данного обзора — обобщить актуальную информацию по алгоритмам оценки состояния мышечной силы, мышечной массы, физической работоспособности, диагностическим критериям саркопении различных исследовательских групп. В обзоре описаны варианты лабораторных маркеров, перспективных и представляющих интерес в отношении диагностики и определения эффективности проведения терапевтических и профилактических вмешательств.
Обоснование: Несовершенный остеогенез (НО) — это редкое наследственное заболевание соединительной ткани, характеризующееся снижением плотности костной ткани и рецидивирующими низкотравматическими переломами. На сегодняшний день бисфосфонаты (БФ) при НО используются с целью увеличения плотности кости и снижения количества новых переломов, однако имеющиеся данные касаются преимущественно использования БФ у детей. При этом, благодаря раннему началу антирезорбтивной терапии, все большее количество пациентов с НО достигают совершеннолетия, что требует определения показаний и оценки эффективности терапии БФ у взрослых пациентов с НО.
Цель исследования: Оценка эффективности терапии бисфосфонатами у взрослых пациентов с несовершенным остеогенезом.
Материалы и методы: Проведено продольное сравнительное исследование 45 пациентов с НО на базе клиники Башкирского государственного медицинского университета. 24 пациента однократно получили золедроновую кислоту 5мг/100 мл внутривенно капельно. Минеральная плотность костной ткани (МПК) определялась при помощи рентгеновской денситометрии. Уровень болевого синдрома оценивался при помощи визуально-аналоговой шкалы. Оценка дисплазии соединительной ткани (ДСТ) проводилась по модифицированной таблице Т. И. Кадуриной.
Результаты: Статистически значимые различия наблюдались при сравнении ИМТ у пациентов с I и III (23,6±4,6; 28,5±5,9; p=0,0183), I и V (23,6±4,6; 30,8±8,2; p=0,014) типами НО. Статистически значимых различий уровней балльно-количественной оценки ДСТ, болевого синдрома по ВАШ и z-критерия между разными типами заболевания не наблюдалось. У пациентов, получивших БФ в КБГМУ наблюдалось статистически значимое уменьшение болевого синдрома (p<0,0001) и увеличение уровня z-критерия (p=0,045) через год после введения препарата, независимо от наличия лечения бисфосфонатами ранее. При проведении корреляционного анализа у пациентов с НО обнаружена умеренная обратная связь между МПК и количеством переломов (r=-0,488, p=0,001), умеренная прямая связь между степенью выраженности ДСТ и уровнем болевого синдрома (r=0,408, p=0,005). Количество переломов также коррелировало с ИМТ (r=0,337, p=0,024).
Заключение: У взрослых пациентов с НО сохраняются низкие уровни показателей МПК и z-критерия, и присутствует умеренный постоянный болевой синдром в костях, не связанный с переломами. Интенсивность данных показателей не зависит от наличия предыдущей терапии бисфосфонатами. Лечение БФ является эффективным, так как наблюдалось статистически значимое увеличение МПК и z-критерия по результатам денситометрии, и статистически значимое уменьшение уровня болевого синдрома в костях. Основными показаниями для введения БФ являются: наличие переломов в течение года, низкие показатели денситометрии (z-критерий<-2,0), наличие умеренного постоянного болевого синдрома в костях (ВАШ>5 баллов).
Издательство
- Издательство
- НМИЦ ЭНДОКРИНОЛОГИИ
- Регион
- Россия, Москва
- Почтовый адрес
- 117292, город Москва, ул. Дмитрия Ульянова, д. 11
- Юр. адрес
- 117292, г Москва, Академический р-н, ул Дмитрия Ульянова, д 11
- ФИО
- Мокрышева Наталья Георгиевна (Директор )
- E-mail адрес
- nmic.endo@endocrincentr.ru
- Контактный телефон
- +7 (499) 6129852