Введение. Фибромиалгия (ФМ) — хроническое болевое состояние, характеризующееся генерализованной болью, сопровождающейся утомляемостью, нарушением сна и когнитивных функций. От 0,2% до 6% населения мира страдает фибромиалгией. ФМ относится к дисфункциональным болевым синдромам, развитие которых обусловлено не повреждением тканей, а нарушением механизмов регуляции в системе болевой чувствительности. Патогенез ФМ сложен и обусловлен целым рядом факторов. В связи с этим разработка экспериментальной модели ФМ для изучения механизмов развития данного заболевания представляется актуальной.
Цель исследования. Разработать экспериментальную модель генерализованной боли у крыс посредством интермиттирующего стрессорного воздействия.
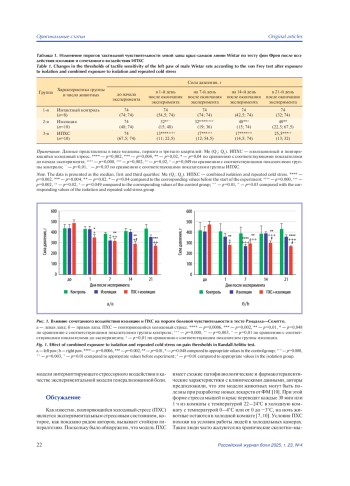
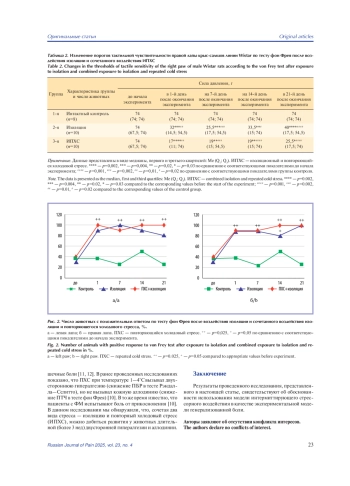
Материал и методы. Опыты проведены на трех группах животных: 1-я группа — интактный контроль; 2-я группа — животные, подвергнутые воздействию изоляции; 3-я группа — животные, подвергнутые сочетанному воздействию изоляционного и повторяющегося холодового стресса (ИПХС). Оценку изменения порогов болевой реакции (ПБР) у животных проводили с помощью электронного алгезиметра Рэндалла—Селитто (IITC, США), а для измерения порога тактильной чувствительности (ПТЧ) использовали эстезиометр фон Фрея с набором филаментов SupertipsTM (IITC, США) диаметром 0,8 мм с силой воздействия от 0,4 до 74 г. Измерения проводили за сутки до начала эксперимента, а также в 1-й, на 7-й, 14-й и 21-й день после его окончания.
Результаты. Разработана экспериментальная модель генерализованной боли с использованием перемежающегося пролонгированного психологического и холодового стрессорного воздействия.
Заключение. Результаты проведенного исследования свидетельствуют об обоснованности использования модели интермиттирующего стрессорного воздействия в качестве экспериментальной модели генерализованной боли.
Идентификаторы и классификаторы
Общепризнанным примером хронической боли в практической медицине является фибромиалгия (ФМ). Распространенность фибромиалгии в общей популяции варьирует от 0,2% до 6%. [1]. Фибромиалгия чаще всего манифестирует вследствие стрессорных воздействий и представляет собой хроническую распространенную боль, ассоциированную с повышенной утомляемостью, нарушением сна, тревожно-депрессивными и когнитивными расстройствами [2]. Патогенез ФМ сложен и не до конца изучен. В реальной клинической практике заболевание плохо диагностируется и трудно поддается терапии, так как причины развития ФМ неясны, несмотря на широкий набор предполагаемых механизмов патогенеза боли и ассоциированных симптомов [3, 4]. В настоящее время считается, что физические и психологические стрессовые события, неадаптивные стратегии преодоления являются предрасполагающими факторами ФМ, вследствие чего возникают нарушения в системах регуляции боли, которые приводят к развитию гипералгезии (повышенной реакции на повреждающие стимулы) и аллодинии (болевых реакций на легкие тактильные и температурные стимулы). Нарушения в центральной обработке боли при ФМ также связывают с нейровоспалением, особой нейропластичностью, обусловленной генетическими полиморфизмами, дисфункцией гипоталамо-гипофизарно-надпочечниковой оси, психологическими проблемами [5].
Список литературы
1. Marques AP, Santo ASDE, Berssaneti AA, Matsutani LA, Yuan SLK. Prevalence of fibromyalgia: literature review update. Rev Bras Reumatol Engl Ed. 2017 July-Aug;57(4):356-363. Epub 2017 Feb 08. PMID: 28743363. (In English, Portuguese). DOI: 10.1016/j.rbre.2017.01.005 PMID: 28743363
2. Давыдов О.С., Глебов М.В. Фибромиалгия. Российский журнал боли. 2020;18(3):66-74. DOI: 10.17116/pain20201803166
Davydov OS, Glebov MV. Fibromyalgia. Russian Journal of Pain. 2020; 18(3):66-74. (In Russ.). DOI: 10.17116/pain20201803166
3. Sluka KA, Clauw DJ. Neurobiology of fibromyalgia and chronic widespread pain. Neuroscience. 2016;338:114-129. DOI: 10.1016/j.neuroscience.2016.06.006
4. Alciati A, Nucera V, Masala IF, Giallanza M, La Corte L, Giorgi V, Sarzi-Puttini P, Atzeni F. One year in review 2021: fibromyalgia. Clin Exp Rheumatol. 2021; 130(3):3-12. Epub 2021 May 13. PMID: 34001307. DOI: 10.55563/clinexprheumatol/gz4i3i PMID: 34001307
5. González-Álvarez ME, Riquelme-Aguado V, González-Pérez Á, Murillo-Llergo R, Manjón-Olmedillas M, Turroni S, Rossettini G, Villafañe JH. Association Between Systemic Neuroinflammation, Pain Perception and Clinical Status in Fibromyalgia Patients: Cross-Sectional Study. Cells. 2024; 13(20):1719. DOI: 10.3390/cells13201719
6. Ueda H, Neyama H. Fibromyalgia Animal Models Using Intermittent Cold and Psychological Stress. Biomedicines. 2023 Dec 25;12(1):56. PMID: 38255163; PMCID: PMC10813244. DOI: 10.3390/biomedicines12010056
7. Wakatsuki K, Kiryu-Seo S, Yasui M, Yokota H, Kida H, Konishi H, Kiyama H. Repeated cold stress, an animal model for fibromyalgia, elicits proprioceptor-induced chronic pain with microglial activation in mice. Journal of Neuroinflammation. 2024 Jan 18;21(1):25. PMID: 38238800; PMCID: PMC10795366. DOI: 10.1186/s12974-024-03018-6 EDN: JCAOZV PMID: 38238800
8. Кузнецова Л.В., Карпова М.Н., Клишина Н.Ю., Кукушкин М.Л. Влияние холодового стресса на болевую чувствительность крыс. Российский журнал боли. 2023;21(3):5-10. DOI: 10.17116/pain2023210315
Kuznetsova LV, Karpova MN, Klishina NYu, Kukushkin ML. Effect of cold stress on pain sensitivity in rats. Russian Journal of Pain. 2023;21(3):5-10. (In Russ.). DOI: 10.17116/pain2023210315
9. Кузнецова Л.В., Клишина Н.Ю., Карпова М.Н., Кукушкин М.Л. Влияние сочетанного воздействия изоляционного и холодового стресса на болевую чувствительность крыс. Патологическая физиология и экспериментальная терапия. 2024;68(2):13-19. DOI: 10.25557/0031-2991.2024.02.13-19
Kuznetsova LV, Klishina NYu, Karpova MN, Kukushkin ML. Effects of the combined isolation stress and cold stress on pain sensitivity of rats. Patologicheskaya fiziologiya i eksperimental’naya terapiya. 2024;68(2):13-19. (In Russ.). DOI: 10.25557/0031-2991.2024.02.13-19
10. Nasu T, Taguchi T, Mizumura K. Persistent deep mechanical hyperalgesia induced by repeated cold stress in rats. Eur J Pain. 2010;14(3):236-244. DOI: 10.1016/j.ejpain.2009.05.009
11. Dovrat E, Katz-Leurer M. Cold exposure and low back pain in store workers in Israel. Am J Ind Med. 2007;50(8):626-631. DOI: 10.1002/ajim.20488
12. Pienimaki T. Cold exposure and musculoskeletal disorders and diseases. A review. Int J Circumpolar Health. 2002;61(2):173-182.
Выпуск
Другие статьи выпуска
Цель исследования. Провести анализ публикаций, посвященных истории развития взглядов на проблему фантомно-болевого синдрома, изучению патогенетических механизмов и лечению данного болевого синдрома.
Материал и методы. Поиск публикаций проведен по базам данных eLibrary, PubMed, Google Scholar, CyberLeninka, Cochrane Library и по электронному каталогу ФГБУ «Российсая государственная библиотека». В анализ включались источники разных лет, имеющие значимые результаты для понимания проблемы фантомно-болевого синдрома, а также источники, имеющие историческую ценность для понимания этапов развития взглядов на проблему.
Результаты. Первое упоминание фантомно-болевого синдрома датируется XVI веком, но до настоящего времени продолжают уточняться патофизиологические механизмы, лежащие в основе развития данного болевого синдрома. Во многом сложности в подборе эффективного лечения обусловлены вовлечением в патогенез фантомной боли многочисленных структур периферической и центральной нервной системы. Анализ исследований показал, что предложенные разнообразные методики лечения не всегда способны избавить пациента от фантомной боли.
Заключение. Современные патофизиологические концепции возникновения и хронизации фантомно-болевого синдрома указывают на необходимость использования для достижения эффективного лечения у одного пациента как медикаментозных, так и немедикаментозных средств.
Дегенеративные поражения позвоночника могут проявляться скелетно-мышечной болью и радикулопатией. Ежегодно в мире регистрируется около 266 млн новых случаев симптомных дегенеративных заболеваний поясничного отдела позвоночника. В основе патологии лежит дегенерация межпозвонкового диска, одним из ключевых факторов развития которой являются провоспалительные цитокины, а также активация металлопротеиназ и механотрансдукция через каналы Piezo1. В обзоре проанализированы патогенетические механизмы дегенеративных поражений позвоночника и проведена оценка эффективности и безопасности системных глюкокортикостероидов при боли в спине дегенеративного генеза на основе клинических исследований последних лет. Показано, что, несмотря на способность глюкокортикостероидов подавлять ключевые медиаторы воспаления, их клиническая эффективность ограниченна: при радикулопатии отмечается лишь кратковременное улучшение, при скелетно-мышечной боли — отсутствие преимуществ перед терапией нестероидными противовоспалительными средствами, при стенозе — отсутствие эффекта. При этом существует риск развития тяжелых осложнений у людей из группы риска (гипертоническая болезнь, сахарный диабет) даже при коротких курсах лечения. Системное применение глюкокортикостероидов для лечения болей в спине при дегенеративных поражениях позвоночника не рекомендовано из-за низкого профиля по соотношению польза/риск.
Лечение пациентов с головной болью напряжения (ГБН) на сегодняшний день направлено на купирование эпизодов головной боли анальгетиками и на уменьшение количества дней с головной болью антидепрессантами. Перспективным направлением является использование миорелаксантов у пациентов с ГБН с мышечным напряжением.
Цель исследования. Изучение эффективности и безопасности эперизона (Стезиум) для лечения пациентов с головной болью напряжения в условиях реальной клинической практики.
Материал и методы. В исследование вошло 30 пациентов (18 мужчин и 12 женщин, средний возраст 39,8±13,9 года). Диагноз частой эпизодической ГБН был у 6 (20%) пациентов, хронической ГБН — у 24 (80%) пациентов.
Результаты. На фоне 8-недельного курса лечения эперизоном (Стезиум, таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, АО «Валента Фарм», Россия, в дозе 75 мг перорально 2 раза в сутки) у пациентов с ГБН происходило статистически значимое снижение количества дней с болью. Так, до лечения в группе в среднем отмечалось 25,0±7,7 дня с ГБН, а после лечения — 11,7±11,6 дня (p<0,001). Интенсивность боли снизилась с 3,8±1,1 балла до 2,5±1,5 балла по визуально-аналоговой шкале (p<0,001). Уровень мышечного напряжения статистически значимо уменьшился в перикраниальных мышцах. Доля пациентов-респондеров на терапию эперизоном составила 63,3% (n=19).
Заключение. Оценка напряжения височных и жевательных мышц в рамках пальпаторной альгометрии может быть использована как предиктор эффективности эперизона у пациентов с головной болью напряжения. Эперизон (Стезиум) может быть рекомендован для комплексного лечения пациентов с головной болью напряжения с мышечным напряжением.
Синдром взрывающейся головы (СВГ) — редкий синдром, ассоциированный со сном, характеризующийся повторяющимися кратковременными приступами ощущения внезапного громкого звука в голове, от которых пациент пробуждается. Согласно Международной классификации нарушений сна 3-го пересмотра (2014), СВГ относится к парасомниям. В литературе отмечена коморбидность СВГ и мигрени. Приводим описание клинического случая СВГ у пациентки с мигренью без ауры и краткий обзор литературы на эту тему.
Цель исследования. 1. Дополнить раздел «Вождение» Индекса ограничения жизнедеятельности из-за боли в шее (далее — Индекс) информацией, оценивающей влияние боли в шее на способность совершать поездки с использованием как общественного, так и личного транспорта. 2. Оценить психометрические свойства модифицированной версии опросника.
Материал и методы. Объект исследования — модифицированная (2020) русскоязычная версия Индекса. На первом этапе провели ретроспективный анализ заполненных анкет и рассчитали процент пропусков для раздела «Вождение». На втором этапе модифицировали раздел «Вождение» и оценили психометрические свойства новой версии опросника. Участники исследования — 337 пациентов (221 женщина и 116 мужчин) в возрасте от 18 до 65 лет (средний возраст 39,6±10,4 года) с неспецифической болью в шее (БШ), головной болью напряжения, мигренью и цервикогенной головной болью (ЦГБ).
Результаты. Ретроспективный анализ показал, что раздел «Вождение» был пропущен в 83 (43%) из 194 анкет, заполненных пациентами с БШ. Для устранения пропусков название этого раздела изменили на «Поездки на транспорте / вождение», а каждое утверждение дополнили фразой «Я езжу на транспорте…», например: «Я езжу на транспорте / вожу машину вообще без боли в шее». Эта модификация исключила пропуски при заполнении анкет. Опросник показал хорошую внутреннюю согласованность: α Кронбаха=0,89, коэффициент межпунктовой корреляции=0,47. Факторный анализ выявил двухфакторную структуру Индекса; во 2-м факторе максимальными факторными нагрузками обладали разделы «Головная боль» (0,878) и «Концентрация внимания» (0,876). Кластерный анализ выявил три отдельных непересекающихся кластера пациентов без ограничения жизнедеятельности, с легким и с умеренным ограничением жизнедеятельности. Группа без ограничения жизнедеятельности состояла преимущественно из пациентов с неспецифической БШ. Группа с умеренным ограничением жизнедеятельности состояла преимущественно из пациентов с хронической мигренью, в том числе сочетавшейся с хронической ЦГБ.
Заключение. Индекс ограничения жизнедеятельности из-за боли в шее, модифицированный для оценки способности пациентов совершать поездки на транспорте, — надежный инструмент, обладающим хорошими психометрическими свойствами, готовый к использованию как в повседневной практике, так и в клинических исследованиях.
Цель исследования. Изучить изменения болевой чувствительности у самок крыс при экспериментальном артрите височнонижнечелюстного сустава в условиях иммуномодуляции.
Материал и методы. Исследование проведено на половозрелых самках крыс (n=51). Сформированы пять экспериментальных групп: 1-я группа — интактные животные; 2-я группа — введение препарата «Имунофан» на 2-е, 4-е, 6-е, 8-е и 10-е сутки исследования; 3-я группа — инъекция монойодацетата натрия (МИА) в височно-нижнечелюстной сустав (ВНЧС) в 1-е сутки исследования; 4-я группа — инъекция МИА в ВНЧС в 1-е сутки исследования с последующим введением «Имунофана» на 2-е, 4-е, 6-е, 8-е и 10-е сутки исследования; 5-я группа — инъекция МИА в ВНЧС в 1-е сутки исследования с последующим введением «Имунофана» на 14-е, 16-е, 18-е, 20-е и 22-е сутки исследования. Порог болевой реакции животных изучали по латентному периоду реакции отведения хвоста при светотермальном раздражении методом tail-flick. Измерения выполняли в фазу диэструса эстрального цикла, определяемую путем микроскопии вагинальных мазков.
Результаты. Снижение латентного периода реакции отведения хвоста, характерное для животных, получивших инъекцию монойодацетата натрия в ВНЧС, не происходит в условиях иммуномодуляции. Указанный эффект «Имунофана» не зависит от времени начала применения препарата.
Заключение. Введение иммуномодулирующего препарата «Имунофан» самкам крыс в относительно ранние сроки формирования артрита височно-нижнечелюстного сустава, вызванного внутрисуставной инъекцией монойодацетата натрия, предупреждает усиление ноцицептивной чувствительности. Применение данного препарата на позднем этапе развития исследуемой патологии приводит к увеличению порога болевой реакции у животных с экспериментальным артритом височно-нижнечелюстного сустава.
Цель исследования. Изучение влияния пептидов GHK, PGP и GHK-PGP на спинальные и супраспинальные механизмы формирования температурной болевой чувствительности у крыс.
Материал и методы. Эксперименты выполнены на 100 крысах-самцах Wistar массой 170—190 г. В работе были использованы пептиды, синтезированные в Национальном исследовательском центре «Курчатовский институт»: GHK (Gly-His-Lys), PGP (Pro-Gly-Pro), GHK-PGP (Gly-His-Lys-Pro-Gly-Pro). Пептиды вводили внутрибрюшинно в дозах 0,5 мкг/кг, 5,0 мкг/кг и 50,0 мкг/кг однократно за 15 мин до начала эксперимента. Контрольным животным вводили эквивалентные объемы физиологического раствора. Болевую чувствительность изучали с использованием теста горячей пластины (hot-plate) и теста отдергивания хвоста от теплового излучения (tail-flick).
Результаты. Установлено, что пептид GHK обладает анальгетическим эффектом при боли, вызванной температурным раздражением в тесте горячей пластины, в дозах 0,5 мкг/кг и 50,0 мкг/кг. У пептида PGP обнаружено анальгетическое действие в минимальной исследуемой дозе. При этом пептид GHK-PGP обладает выраженным анальгетическим действием во всех исследуемых дозах, согласно результатам исследования, в тесте горячей пластины, а также в дозе 0,5 мкг/кг в тесте отдергивания хвоста от теплового излучения.
Заключение. Пептиды GHK и PGP обладают анальгетическим эффектом. При этом присоединение PGP к С-концу аминокислотной последовательности GHK потенцирует анальгетическое действие, которое проявляется во всех исследованных дозах. Также пептид GHK-PGP демонстрирует анальгетическое действие в тесте отдергивания хвоста от теплового излучения, что свидетельствует об активации сегментарных механизмов болевой чувствительности.
Цель исследования. Изучить в эксперименте антиноцицептивную активность агониста каннабиноидного СВ1-рецептора производного 2H-хромена (шифр — CHR) на моделях послеоперационной и нейропатической боли, оценить вклад потенциального антиэкссудативного эффекта в механизм его антиноцицептивного действия.
Материал и методы. Исследование выполняли на мышах CD-1 и крысах Sprague Dawley. Животным в желудок вводили производное 2H-хромена CHR в эффективной дозе 5 мг/кг. Антиноцицептивную активность соединения CHR оценивали на моделях послеоперационной и нейропатической боли в сравнении с действием трамадола в дозе 20 мг/кг и габапентина в дозе 100 мг/кг. Антиэкссудативное и антиноцицептивное влияние соединения CHR исследовали при однократном введении крысам на модели отека задней конечности, вызванного каррагенином, сравнивали с эффектами диклофенака натрия в дозе 10 мг/кг.
Результаты. Соединение CHR повышало болевой порог на модели послеоперационной боли в 40 раз, при экспериментальной нейропатической боли — с 1-го по 7-й день исследования в 3,5 раза, 70 раз и 100 раз соответственно. Антиноцицептивный эффект соединения CHR выражен не слабее действия трамадола и габапентина. На модели отека задней конечности вещество CHR ослабляло экссудацию на 42%, диклофенак натрия уменьшал экссудацию на 67%, оба соединения увеличивали болевой порог в 15 раз (p<0,05).
Заключение. Производное 2H-хромена CHR в эффективной дозе 5 мг/кг оказывает выраженное антиноцицептивное действие при экспериментальной послеоперационной и нейропатической боли. Соединение CHR препятствует развитию экссудации слабее диклофенака натрия, но в такой же степени оказывает антиноцицептивное действие.
Цель работы. Провести сравнительное изучение болевой чувствительности в тесте hot-plate у самцов и самок крыс, проживавших в условиях социальной изоляции в течение года.
Материал и методы. Работа проведена на 69 крысах Wistar под контролем этического комитета ФГБНУ «НИИОПП». После отсаживания крысят от матери на 29-й постнатальный день их распределяли в 4 группы: социально изолированные самки (n=17) и самцы (n=18), которых содержали поодиночке в течение всего эксперимента, контрольные самки (n=17) и самцы (n=17), которых содержали по 4—5 особей в клетке. Пороги болевых реакций (ПБР) оценивали в тесте hot-plate при t=55±0,3°C по латентному периоду появления избавляющих реакций облизывания передней лапки, задней лапки и прыжка. Тестирование половины крыс проводили в возрасте 10,5 мес, всех крыс — в возрасте 12,5 мес. Статистическую обработку результатов проводили с использованием Factorial и Repeated Measures ANOVA.
Результаты. Выявлено повышение ПБР у социально изолированных крыс по сравнению с крысами, которых содержали в группах, по увеличению латентного периода облизывания передней лапки (F(1,62)=11,517, p=0,001) и задней лапки (F(1,60)=5,005, p=0,029). У социально изолированных самок и у самцов контрольной группы ПБР облизывания задней лапки были выше, чем у самок контрольной группы. ПБР облизывания задней лапки и прыжка снижались с увеличением возраста у крыс обоего пола, независимо от условий содержания.
Заключение. Повышение ПБР в тесте hot-plate у крыс обоего пола на поздних сроках социальной изоляции в случае ее раннего начала свидетельствует о развитии гипоалгезии, возможно связанной с процессами адаптации к длительному психосоциальному стрессу. Снижение термической болевой чувствительности было более выраженным у самок, чем у самцов.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- МЕДИА СФЕРА
- Регион
- Россия, Москва
- Почтовый адрес
- Издательство «Медиа Сфера», а/я 54, Москва, Россия, 127238
- Юр. адрес
- 127238, город Москва, Дмитровское ш, д. 46 к. 2 стр. 2
- ФИО
- Немцова Нина Валерьевна (ГЕНЕРАЛЬНЫЙ ДИРЕКТОР)
- E-mail адрес
- info@mediasphera.ru
- Контактный телефон
- +7 (495) 4824329