Цель исследования. Изучить в эксперименте антиноцицептивную активность агониста каннабиноидного СВ1-рецептора производного 2H-хромена (шифр — CHR) на моделях послеоперационной и нейропатической боли, оценить вклад потенциального антиэкссудативного эффекта в механизм его антиноцицептивного действия.
Материал и методы. Исследование выполняли на мышах CD-1 и крысах Sprague Dawley. Животным в желудок вводили производное 2H-хромена CHR в эффективной дозе 5 мг/кг. Антиноцицептивную активность соединения CHR оценивали на моделях послеоперационной и нейропатической боли в сравнении с действием трамадола в дозе 20 мг/кг и габапентина в дозе 100 мг/кг. Антиэкссудативное и антиноцицептивное влияние соединения CHR исследовали при однократном введении крысам на модели отека задней конечности, вызванного каррагенином, сравнивали с эффектами диклофенака натрия в дозе 10 мг/кг.
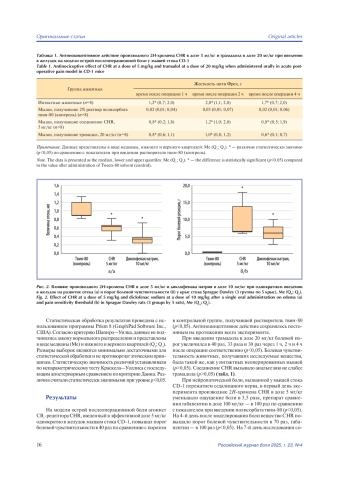
Результаты. Соединение CHR повышало болевой порог на модели послеоперационной боли в 40 раз, при экспериментальной нейропатической боли — с 1-го по 7-й день исследования в 3,5 раза, 70 раз и 100 раз соответственно. Антиноцицептивный эффект соединения CHR выражен не слабее действия трамадола и габапентина. На модели отека задней конечности вещество CHR ослабляло экссудацию на 42%, диклофенак натрия уменьшал экссудацию на 67%, оба соединения увеличивали болевой порог в 15 раз (p<0,05).
Заключение. Производное 2H-хромена CHR в эффективной дозе 5 мг/кг оказывает выраженное антиноцицептивное действие при экспериментальной послеоперационной и нейропатической боли. Соединение CHR препятствует развитию экссудации слабее диклофенака натрия, но в такой же степени оказывает антиноцицептивное действие.
Идентификаторы и классификаторы
Арсенал лекарственных средств, эффективных для купирования боли, включает опиоидные и неопиоидные анальгетики, нестероидные противовоспалительные средства (НПВС), центральные миорелаксанты, некоторые антидепрессанты и противоэпилептические средства. Агонисты опиоидных рецепторов оказывают наиболее выраженное анальгетическое влияние при сильной и умеренной боли, но угнетают дыхательный центр, вызывают сонливость, обстипацию, создают риск психической и физической зависимости [1]. Неопиоидные анальгетики и НПВС применяют при боли легкой и средней интенсивности, они особенно эффективны при боли, вызванной воспалением. НПВС обладают нефротоксичностью и гепатотоксичностью, кроме того, прием НПВС сопряжен с повреждением слизистой оболочки желудка, нарушением работы сердечно-сосудистой системы [2]. Антидепрессанты и противоэпилептические средства оказывают плейотропное анальгетическое действие только при некоторых видах нейропатической боли [3, 4]. Центральные миорелаксанты эффективны лишь при мышечно-тонических синдромах [4]. Для более эффективной и безопасной фармакотерапии болевого синдрома актуально создание анальгетиков с новым механизмом действия.
Список литературы
1. Alorfi NM. Pharmacological Methods of Pain Management: Narrative Review of Medication Used. Int J Gen Med. 2023;16:3247-3256. DOI: 10.2147/IJGM.S419239
2. Ribeiro H, Rodrigues I, Napoleão L, Lira L, Marques D, Veríssimo M, Andrade JP, Dourado M. Non-steroidal anti-inflammatory drugs (NSAIDs), pain and aging: Adjusting prescription to patient features. Biomed Pharmacother. 2022;150:112958. PMID: 35453005. DOI: 10.1016/j.biopha.2022.112958 PMID: 35453005
3. Wiffen PJ, Derry S, Moore RA, Aldington D, Cole P, Rice AS, Lunn MP, Hamunen K, Haanpaa M, Kalso EA. Antiepileptic drugs for neuropathic pain and fibromyalgia - an overview of Cochrane reviews. Cochrane Database Syst Rev. 2013;(11):CD010567. DOI: 10.1002/14651858.CD010567.pub2
4. Marcianò G, Vocca C, Evangelista M, Palleria C, Muraca L, Galati C, Monea F, Sportiello L, De Sarro G, Capuano A, Gallelli L. The Pharmacological Treatment of Chronic Pain: From Guidelines to Daily Clinical Practice. Pharmaceutics. 2023;15(4):1165. DOI: 10.3390/pharmaceutics15041165
5. Leo LM, Abood ME. CB1 Cannabinoid Receptor Signaling and Biased Signaling. Molecules. 2021;26(17):5413. DOI: 10.3390/molecules26175413
6. Palazzo E, Luongo L, Novellis V, Rossi F, Maione S. The Role of Cannabinoid Receptors in the Descending Modulation of Pain. Pharmaceuticals (Basel). 2010;3(8):2661-2673. DOI: 10.3390/ph3082661
7. Vučković S, Srebro D, Vujović KS, Vučetić Č, Prostran M. Cannabinoids and Pain: New Insights From Old Molecules. Front Pharmacol. 2018;9:1259. DOI: 10.3389/fphar.2018.01259
8. Chung EY, Cha HJ, Min HK, Yun J. Pharmacology and adverse effects of new psychoactive substances: synthetic cannabinoid receptor agonists. Arch Pharm Res. 2021;44(4):402-413. DOI: 10.1007/s12272-021-01326-6
9. Nazimova E, Pavlova A, Mikhalchenko O, Il’ina I, Korchagina D, Tolstikova T, Volcho K, Salakhutdinov N. Discovery of highly potent analgesic activity of isopulegol-derived (2R,4aR,7R,8aR)-4,7-dimethyl-2-(thiophen-2-yl)octahydro-2H-chromen-4-ol. Med Chem Res. 2016;25(7):1369-1383. DOI: 10.1007/s00044-016-1573-3
10. Гуркин Н.В., Быков В.В., Быкова А.В., Мотов В.С., Ларченко В.В., Ильина И.В., Хазанов В.А., Волчо К.П., Салахутдинов Н.Ф., Венгеровский А.И. Анальгетическая активность нового модулятора каннабиноидного CB1-рецептора. Бюллетень сибирской медицины. 2024; 23(3):42-48. DOI: 10.20538/1682-0363-2024-3-42-48
Gurkin NV, Bykov VV, Bykova AV, Motov VS, Larchenko VV, Il’ina IV, Khazanov VA, Volcho KP, Salakhutdinov NF, Vengerovskii AI. Analgesic activity of a new cannabinoid CB1 receptor modulator. Bulletin of Siberian Medicine. 2024;23(3):42-48. (In Russ.). DOI: 10.20538/1682-0363-2024-3-42-48
11. Гуркин Н.В., Быков В.В., Быкова А.В., Ильина И.В., Волчо К.П., Салахутдинов Н.Ф., Хазанов В.А., Венгеровский А.И. Психотропное действие нового анальгетика - агониста CB1-рецепторов. Экспериментальная и клиническая фармакология. 2025;88(1):8-11. DOI: 10.30906/0869-2092-2025-88-1-8-11
Gurkin NV, Bykov VV, Bykova AV, Il’ina IV, Volcho KP, Salakhutdinov NF, Khazanov VA, Vengerovskii AI. Psychotropic effects of a new analgesic - CB1 receptor agonist. Eksperimental’naya i klinicheskaya farmakologiya. 2025;88(1):8-11. (In Russ.). DOI: 10.30906/0869-2092-2025-88-1-8-11
12. Bandapati S, Podila KS., Yadala VR. Comparative study of anti-nociceptive effect of venlafaxine with tramadol by tail-flick test in animal model of mice. Natl J Physiol Pharm Pharmacol. 2021;11(06):633-637. DOI: 10.5455/njppp.2021.11.11307202001022021
13. Scuteri D, Rombolà L, Natoli S, Pisani A, Bonsi P, Watanabe C, Bagetta G, Tonin P, Corasaniti MT. Effect of Gabapentin in a Neuropathic Pain Model in Mice Overexpressing Human Wild-Type or Human Mutated Torsin A. Life (Basel). 2021;11(1):41. DOI: 10.3390/life11010041
14. Gias ZT, Afsana F, Debnath P, Alam MS, Ena TN, Hossain MH, Jain P, Reza HM. A mechanistic approach to HPLC analysis, antinociceptive, anti-inflammatory and postoperative analgesic activities of panch phoron in mice. BMC Complement Med Ther. 2020;20(1):102. DOI: 10.1186/s12906-020-02891-x
15. Cowie AM, Stucky CL. A Mouse Model of Postoperative Pain. Bio Protoc. 2019;9(2):e3140. DOI: 10.21769/BioProtoc.3140
16. Торопкина Ю.Е., Романенко Ю.В., Налетова Д.А., Алексеев В.В., Овсянников В.Г., Алексеева Н.С., Кривохлябов И.П., Попивненко М.Д. Лабораторные модели нейропатической боли: обзор и практические рекомендации. Российский журнал боли. 2023;21(2):38-49. DOI: 10.17116/pain20232102138
Toropkina YuE, Romanenko YuV, Naletova DA, Alekseev VV, Ovsyannikov VG, Alekseeva NS, Krivokhlyabov IP, Popivnenko MD. Laboratory models of neuropathic pain: review and practical recommendations. Russian Journal of Pain. 2023;21(2):38-49. (In Russ.). DOI: 10.17116/pain20232102138
17. Interdonato L, Ferrario G, Cordaro M, D’Amico R, Siracusa R, Fusco R, Impellizzeri D, Cuzzocrea S, Aldini G, Di Paola R. Targeting Nrf2 and NF-κB Signaling Pathways in Inflammatory Pain: The Role of Polyphenols from Thinned Apples. Molecules. 2023;28(14):5376. DOI: 10.3390/molecules28145376
18. Brenner D, Shorten GD, O’Mahony SM. Postoperative pain and the gut microbiome. Neurobiol Pain. 2021;10:100070. DOI: 10.1016/j.ynpai.2021.100070
19. Rosenberger DC, Blechschmidt V, Timmerman H, Wolff A, Treede RD. Challenges of neuropathic pain: focus on diabetic neuropathy. J Neural Transm (Vienna). 2020;127(4):589-624. DOI: 10.1007/s00702-020-02145-7
20. Alkaitis MS, Solorzano C, Landry RP, Piomelli D, DeLeo JA, Romero-Sandoval EA. Evidence for a role of endocannabinoids, astrocytes and p38 phosphorylation in the resolution of postoperative pain. PLoS One. 2010;5(5):e10891. DOI: 10.1371/journal.pone.0010891
21. Richebé P, Capdevila X, Rivat C. Persistent Postsurgical Pain: Pathophysiology and Preventative Pharmacologic Considerations. Anesthesiology. 2018; 129(3):590-607. DOI: 10.1097/ALN.0000000000002238
22. Zhang M, Wang T, Meng F, Jiang M, Wu S, Xu H. The endocannabinoid system in the brain undergoes long-lasting changes following neuropathic pain. iScience. 2024;27(12):111409. DOI: 10.1016/j.isci.2024.111409
23. Rock EM, Limebeer CL, Parker LA. Effect of cannabidiolic acid and ∆9-tetrahydrocannabinol on carrageenan-induced hyperalgesia and edema in a rodent model of inflammatory pain. Psychopharmacology (Berl). 2018; 235(11):3259-3271. DOI: 10.1007/s00213-018-5034-1
24. Bouchet CA, Ingram SL. Cannabinoids in the descending pain modulatory circuit: Role in inflammation. Pharmacol Ther. 2020;209:107495.
Выпуск
Другие статьи выпуска
Цель исследования. Провести анализ публикаций, посвященных истории развития взглядов на проблему фантомно-болевого синдрома, изучению патогенетических механизмов и лечению данного болевого синдрома.
Материал и методы. Поиск публикаций проведен по базам данных eLibrary, PubMed, Google Scholar, CyberLeninka, Cochrane Library и по электронному каталогу ФГБУ «Российсая государственная библиотека». В анализ включались источники разных лет, имеющие значимые результаты для понимания проблемы фантомно-болевого синдрома, а также источники, имеющие историческую ценность для понимания этапов развития взглядов на проблему.
Результаты. Первое упоминание фантомно-болевого синдрома датируется XVI веком, но до настоящего времени продолжают уточняться патофизиологические механизмы, лежащие в основе развития данного болевого синдрома. Во многом сложности в подборе эффективного лечения обусловлены вовлечением в патогенез фантомной боли многочисленных структур периферической и центральной нервной системы. Анализ исследований показал, что предложенные разнообразные методики лечения не всегда способны избавить пациента от фантомной боли.
Заключение. Современные патофизиологические концепции возникновения и хронизации фантомно-болевого синдрома указывают на необходимость использования для достижения эффективного лечения у одного пациента как медикаментозных, так и немедикаментозных средств.
Дегенеративные поражения позвоночника могут проявляться скелетно-мышечной болью и радикулопатией. Ежегодно в мире регистрируется около 266 млн новых случаев симптомных дегенеративных заболеваний поясничного отдела позвоночника. В основе патологии лежит дегенерация межпозвонкового диска, одним из ключевых факторов развития которой являются провоспалительные цитокины, а также активация металлопротеиназ и механотрансдукция через каналы Piezo1. В обзоре проанализированы патогенетические механизмы дегенеративных поражений позвоночника и проведена оценка эффективности и безопасности системных глюкокортикостероидов при боли в спине дегенеративного генеза на основе клинических исследований последних лет. Показано, что, несмотря на способность глюкокортикостероидов подавлять ключевые медиаторы воспаления, их клиническая эффективность ограниченна: при радикулопатии отмечается лишь кратковременное улучшение, при скелетно-мышечной боли — отсутствие преимуществ перед терапией нестероидными противовоспалительными средствами, при стенозе — отсутствие эффекта. При этом существует риск развития тяжелых осложнений у людей из группы риска (гипертоническая болезнь, сахарный диабет) даже при коротких курсах лечения. Системное применение глюкокортикостероидов для лечения болей в спине при дегенеративных поражениях позвоночника не рекомендовано из-за низкого профиля по соотношению польза/риск.
Лечение пациентов с головной болью напряжения (ГБН) на сегодняшний день направлено на купирование эпизодов головной боли анальгетиками и на уменьшение количества дней с головной болью антидепрессантами. Перспективным направлением является использование миорелаксантов у пациентов с ГБН с мышечным напряжением.
Цель исследования. Изучение эффективности и безопасности эперизона (Стезиум) для лечения пациентов с головной болью напряжения в условиях реальной клинической практики.
Материал и методы. В исследование вошло 30 пациентов (18 мужчин и 12 женщин, средний возраст 39,8±13,9 года). Диагноз частой эпизодической ГБН был у 6 (20%) пациентов, хронической ГБН — у 24 (80%) пациентов.
Результаты. На фоне 8-недельного курса лечения эперизоном (Стезиум, таблетки с пролонгированным высвобождением, покрытые пленочной оболочкой, АО «Валента Фарм», Россия, в дозе 75 мг перорально 2 раза в сутки) у пациентов с ГБН происходило статистически значимое снижение количества дней с болью. Так, до лечения в группе в среднем отмечалось 25,0±7,7 дня с ГБН, а после лечения — 11,7±11,6 дня (p<0,001). Интенсивность боли снизилась с 3,8±1,1 балла до 2,5±1,5 балла по визуально-аналоговой шкале (p<0,001). Уровень мышечного напряжения статистически значимо уменьшился в перикраниальных мышцах. Доля пациентов-респондеров на терапию эперизоном составила 63,3% (n=19).
Заключение. Оценка напряжения височных и жевательных мышц в рамках пальпаторной альгометрии может быть использована как предиктор эффективности эперизона у пациентов с головной болью напряжения. Эперизон (Стезиум) может быть рекомендован для комплексного лечения пациентов с головной болью напряжения с мышечным напряжением.
Синдром взрывающейся головы (СВГ) — редкий синдром, ассоциированный со сном, характеризующийся повторяющимися кратковременными приступами ощущения внезапного громкого звука в голове, от которых пациент пробуждается. Согласно Международной классификации нарушений сна 3-го пересмотра (2014), СВГ относится к парасомниям. В литературе отмечена коморбидность СВГ и мигрени. Приводим описание клинического случая СВГ у пациентки с мигренью без ауры и краткий обзор литературы на эту тему.
Цель исследования. 1. Дополнить раздел «Вождение» Индекса ограничения жизнедеятельности из-за боли в шее (далее — Индекс) информацией, оценивающей влияние боли в шее на способность совершать поездки с использованием как общественного, так и личного транспорта. 2. Оценить психометрические свойства модифицированной версии опросника.
Материал и методы. Объект исследования — модифицированная (2020) русскоязычная версия Индекса. На первом этапе провели ретроспективный анализ заполненных анкет и рассчитали процент пропусков для раздела «Вождение». На втором этапе модифицировали раздел «Вождение» и оценили психометрические свойства новой версии опросника. Участники исследования — 337 пациентов (221 женщина и 116 мужчин) в возрасте от 18 до 65 лет (средний возраст 39,6±10,4 года) с неспецифической болью в шее (БШ), головной болью напряжения, мигренью и цервикогенной головной болью (ЦГБ).
Результаты. Ретроспективный анализ показал, что раздел «Вождение» был пропущен в 83 (43%) из 194 анкет, заполненных пациентами с БШ. Для устранения пропусков название этого раздела изменили на «Поездки на транспорте / вождение», а каждое утверждение дополнили фразой «Я езжу на транспорте…», например: «Я езжу на транспорте / вожу машину вообще без боли в шее». Эта модификация исключила пропуски при заполнении анкет. Опросник показал хорошую внутреннюю согласованность: α Кронбаха=0,89, коэффициент межпунктовой корреляции=0,47. Факторный анализ выявил двухфакторную структуру Индекса; во 2-м факторе максимальными факторными нагрузками обладали разделы «Головная боль» (0,878) и «Концентрация внимания» (0,876). Кластерный анализ выявил три отдельных непересекающихся кластера пациентов без ограничения жизнедеятельности, с легким и с умеренным ограничением жизнедеятельности. Группа без ограничения жизнедеятельности состояла преимущественно из пациентов с неспецифической БШ. Группа с умеренным ограничением жизнедеятельности состояла преимущественно из пациентов с хронической мигренью, в том числе сочетавшейся с хронической ЦГБ.
Заключение. Индекс ограничения жизнедеятельности из-за боли в шее, модифицированный для оценки способности пациентов совершать поездки на транспорте, — надежный инструмент, обладающим хорошими психометрическими свойствами, готовый к использованию как в повседневной практике, так и в клинических исследованиях.
Цель исследования. Изучить изменения болевой чувствительности у самок крыс при экспериментальном артрите височнонижнечелюстного сустава в условиях иммуномодуляции.
Материал и методы. Исследование проведено на половозрелых самках крыс (n=51). Сформированы пять экспериментальных групп: 1-я группа — интактные животные; 2-я группа — введение препарата «Имунофан» на 2-е, 4-е, 6-е, 8-е и 10-е сутки исследования; 3-я группа — инъекция монойодацетата натрия (МИА) в височно-нижнечелюстной сустав (ВНЧС) в 1-е сутки исследования; 4-я группа — инъекция МИА в ВНЧС в 1-е сутки исследования с последующим введением «Имунофана» на 2-е, 4-е, 6-е, 8-е и 10-е сутки исследования; 5-я группа — инъекция МИА в ВНЧС в 1-е сутки исследования с последующим введением «Имунофана» на 14-е, 16-е, 18-е, 20-е и 22-е сутки исследования. Порог болевой реакции животных изучали по латентному периоду реакции отведения хвоста при светотермальном раздражении методом tail-flick. Измерения выполняли в фазу диэструса эстрального цикла, определяемую путем микроскопии вагинальных мазков.
Результаты. Снижение латентного периода реакции отведения хвоста, характерное для животных, получивших инъекцию монойодацетата натрия в ВНЧС, не происходит в условиях иммуномодуляции. Указанный эффект «Имунофана» не зависит от времени начала применения препарата.
Заключение. Введение иммуномодулирующего препарата «Имунофан» самкам крыс в относительно ранние сроки формирования артрита височно-нижнечелюстного сустава, вызванного внутрисуставной инъекцией монойодацетата натрия, предупреждает усиление ноцицептивной чувствительности. Применение данного препарата на позднем этапе развития исследуемой патологии приводит к увеличению порога болевой реакции у животных с экспериментальным артритом височно-нижнечелюстного сустава.
Цель исследования. Изучение влияния пептидов GHK, PGP и GHK-PGP на спинальные и супраспинальные механизмы формирования температурной болевой чувствительности у крыс.
Материал и методы. Эксперименты выполнены на 100 крысах-самцах Wistar массой 170—190 г. В работе были использованы пептиды, синтезированные в Национальном исследовательском центре «Курчатовский институт»: GHK (Gly-His-Lys), PGP (Pro-Gly-Pro), GHK-PGP (Gly-His-Lys-Pro-Gly-Pro). Пептиды вводили внутрибрюшинно в дозах 0,5 мкг/кг, 5,0 мкг/кг и 50,0 мкг/кг однократно за 15 мин до начала эксперимента. Контрольным животным вводили эквивалентные объемы физиологического раствора. Болевую чувствительность изучали с использованием теста горячей пластины (hot-plate) и теста отдергивания хвоста от теплового излучения (tail-flick).
Результаты. Установлено, что пептид GHK обладает анальгетическим эффектом при боли, вызванной температурным раздражением в тесте горячей пластины, в дозах 0,5 мкг/кг и 50,0 мкг/кг. У пептида PGP обнаружено анальгетическое действие в минимальной исследуемой дозе. При этом пептид GHK-PGP обладает выраженным анальгетическим действием во всех исследуемых дозах, согласно результатам исследования, в тесте горячей пластины, а также в дозе 0,5 мкг/кг в тесте отдергивания хвоста от теплового излучения.
Заключение. Пептиды GHK и PGP обладают анальгетическим эффектом. При этом присоединение PGP к С-концу аминокислотной последовательности GHK потенцирует анальгетическое действие, которое проявляется во всех исследованных дозах. Также пептид GHK-PGP демонстрирует анальгетическое действие в тесте отдергивания хвоста от теплового излучения, что свидетельствует об активации сегментарных механизмов болевой чувствительности.
Введение. Фибромиалгия (ФМ) — хроническое болевое состояние, характеризующееся генерализованной болью, сопровождающейся утомляемостью, нарушением сна и когнитивных функций. От 0,2% до 6% населения мира страдает фибромиалгией. ФМ относится к дисфункциональным болевым синдромам, развитие которых обусловлено не повреждением тканей, а нарушением механизмов регуляции в системе болевой чувствительности. Патогенез ФМ сложен и обусловлен целым рядом факторов. В связи с этим разработка экспериментальной модели ФМ для изучения механизмов развития данного заболевания представляется актуальной.
Цель исследования. Разработать экспериментальную модель генерализованной боли у крыс посредством интермиттирующего стрессорного воздействия.
Материал и методы. Опыты проведены на трех группах животных: 1-я группа — интактный контроль; 2-я группа — животные, подвергнутые воздействию изоляции; 3-я группа — животные, подвергнутые сочетанному воздействию изоляционного и повторяющегося холодового стресса (ИПХС). Оценку изменения порогов болевой реакции (ПБР) у животных проводили с помощью электронного алгезиметра Рэндалла—Селитто (IITC, США), а для измерения порога тактильной чувствительности (ПТЧ) использовали эстезиометр фон Фрея с набором филаментов SupertipsTM (IITC, США) диаметром 0,8 мм с силой воздействия от 0,4 до 74 г. Измерения проводили за сутки до начала эксперимента, а также в 1-й, на 7-й, 14-й и 21-й день после его окончания.
Результаты. Разработана экспериментальная модель генерализованной боли с использованием перемежающегося пролонгированного психологического и холодового стрессорного воздействия.
Заключение. Результаты проведенного исследования свидетельствуют об обоснованности использования модели интермиттирующего стрессорного воздействия в качестве экспериментальной модели генерализованной боли.
Цель работы. Провести сравнительное изучение болевой чувствительности в тесте hot-plate у самцов и самок крыс, проживавших в условиях социальной изоляции в течение года.
Материал и методы. Работа проведена на 69 крысах Wistar под контролем этического комитета ФГБНУ «НИИОПП». После отсаживания крысят от матери на 29-й постнатальный день их распределяли в 4 группы: социально изолированные самки (n=17) и самцы (n=18), которых содержали поодиночке в течение всего эксперимента, контрольные самки (n=17) и самцы (n=17), которых содержали по 4—5 особей в клетке. Пороги болевых реакций (ПБР) оценивали в тесте hot-plate при t=55±0,3°C по латентному периоду появления избавляющих реакций облизывания передней лапки, задней лапки и прыжка. Тестирование половины крыс проводили в возрасте 10,5 мес, всех крыс — в возрасте 12,5 мес. Статистическую обработку результатов проводили с использованием Factorial и Repeated Measures ANOVA.
Результаты. Выявлено повышение ПБР у социально изолированных крыс по сравнению с крысами, которых содержали в группах, по увеличению латентного периода облизывания передней лапки (F(1,62)=11,517, p=0,001) и задней лапки (F(1,60)=5,005, p=0,029). У социально изолированных самок и у самцов контрольной группы ПБР облизывания задней лапки были выше, чем у самок контрольной группы. ПБР облизывания задней лапки и прыжка снижались с увеличением возраста у крыс обоего пола, независимо от условий содержания.
Заключение. Повышение ПБР в тесте hot-plate у крыс обоего пола на поздних сроках социальной изоляции в случае ее раннего начала свидетельствует о развитии гипоалгезии, возможно связанной с процессами адаптации к длительному психосоциальному стрессу. Снижение термической болевой чувствительности было более выраженным у самок, чем у самцов.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- МЕДИА СФЕРА
- Регион
- Россия, Москва
- Почтовый адрес
- Издательство «Медиа Сфера», а/я 54, Москва, Россия, 127238
- Юр. адрес
- 127238, город Москва, Дмитровское ш, д. 46 к. 2 стр. 2
- ФИО
- Немцова Нина Валерьевна (ГЕНЕРАЛЬНЫЙ ДИРЕКТОР)
- E-mail адрес
- info@mediasphera.ru
- Контактный телефон
- +7 (495) 4824329