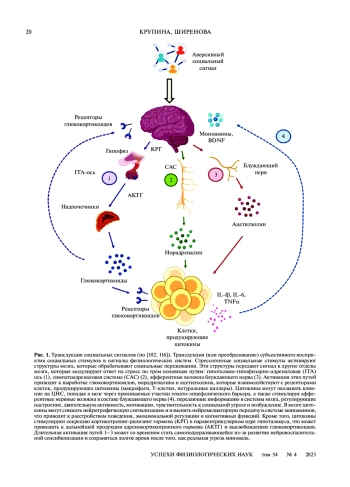
Наличие близких социальных связей – необходимое условие для психического и физического здоровья и благополучия в любом возрасте. Существенный процент населения Земли пережил условия “локдауна” в связи с пандемией COVID-19. Появляется все больше данных научной литературы, посвященных негативному воздействию социальной изоляции на внимание, память, восприятие, исполнительные функции и другие аспекты когнитивных процессов. Это может усложнять повседневную жизнь людей, снижая качество жизни. В обзоре предпринята попытка систематизации накопленных научных фактов о взаимосвязи социальной изоляции и развития нарушений когнитивных функций у человека, собранных в лонгитюдных популяционных исследованиях, а также проведен анализ данных о влиянии социальной изоляции разной длительности на процессы обучения и памяти, полученных в экспериментальных исследованиях на животных. Затронуты вопросы возможной связи этих нарушений, индуцированных социальной изоляцией, с изменением функционирования одной из систем стресс-реактивности – гипоталамо-гипофизарно-адреналовой оси и иммуновоспалительным ответом.
Идентификаторы и классификаторы
- SCI
- Биология
Социальную изоляцию определяют как явление, при котором вследствие разных причин происходит отторжение индивида или социальной группы от других индивидов или социальных групп в результате резкого сокращения (социальная депривация) или полного прекращения (собственно, изоляция) социальных контактов [66].
Список литературы
1. Василенко Е.А. Социальный стресс и его влияние на социально-психологическую адаптацию личности. Челябинск: Южно-Уральский научный центр Российской академии образования, 2019. 272 с.
2. Ватаева Л.А., Михайленко В.А., Кассиль В.Г. Влияние сроков отлучения от самки на поведение в открытом поле и состояние симпатоадреналовой системы у крыс, выращенных в условиях социальной изоляции // Журн. эвол. биохим. физиол. 2002. Т. 38. № 1. С. 66. PMID: 11966207.
3. Крупина Н.А., Хлебникова Н.Н., Орлова И.Н. Ранняя социальная изоляция увеличивает агрессивность и нарушает кратковременное привыкание у крыс // Патол. физиол. эксп. тер. 2015. Т. 59. № 4. С. 4. PMID: 27116871. EDN: VXPOFV
4. Крупина Н.А., Ширенова С.Д., Хлебникова Н.Н. Длительная социальная изоляция ухудшает обучение в тесте условного рефлекса активного избегания у самок крыс // Тезисы XIX международного междисциплинарного конгресса “НЕЙРОНАУКА ДЛЯ МЕДИЦИНЫ И ПСИХОЛОГИИ”, 4-10 июня 2023 г., Судак, Крым, Россия. С. 162. DOI: 10.29003/m3276.sudak.ns2023-19/162-163 EDN: BZNGXY
5. Левшина И.П., Пасикова Н.В., Шуйкин Н.Н. Выработка условных реакций избегания и морфометрические характеристики сенсомоторной коры крыс, социально депривированных в раннем онтогенезе // Журн. высш. нерв. деят. им. И.П. Павлова. 2005. Т. 55. № 4. С. 558. PMID: 16217971. EDN: HSGEPT
6. Меркулов В.М., Меркулова Т.И., Бондарь Н.П. Механизмы формирования глюкокортикоидной резистентности в структурах головного мозга при стресс-индуцированных психопатологиях // Биохимия. 2017. Т. 82. № 3. С. 494. EDN: YKUQAJ
7. Павлова И.В., Брошевицкая Н.Д., Онуфриев М.В., Моисеева Ю.В. Половые различия в тревожно-депрессивном и оборонительном поведении крыс Вистар // Журн. высш. нерв. деят. им. И.П. Павлова. 2020. Т. 70. № 2. С. 243. DOI: 10.31857/S0044467720020100 EDN: EWZRDB
8. Хлебникова Н.Н., Медведева Ю.С., Крупина Н.А. Ранняя социальная изоляция, вызывающая эмоционально-мотивационные нарушения у крыс, сопровождается дефицитом кратковременного привыкания, но не влияет на пространственную память // Журн. высш. нерв. деят. им. И.П. Павлова. 2018. Т. 68. № 5. С. 646. DOI: 10.1134/S0044467718050052 EDN: YMOURF
9. Ширенова С.Д. Влияние социальной изоляции на выработку условного рефлекса пассивного избегания у самок крыс. Cognitive Neuroscience - 2020: материалы международного форума, 11-12 декабря 2020 г., Екатеринбург // [отв. ред. Э.Э. Сыманюк]; Министерство науки и высшего образования Российской Федерации, Уральский федеральный университет. Екатеринбург: Изд-во Урал. Ун-та. 2021. Екатеринбург, 11-12 декабря, 2020. С. 329. EDN: CLLLBQ
10. Ширенова С.Д., Хлебникова Н.Н., Крупина Н.А. Изменения социальности и предпочтения социальной новизны у самок крыс в условиях пролонгированной социальной изоляции // Журн. высш. нерв. деят. им. И.П. Павлова. 2022. Т. 72. № 4. С. 520. DOI: 10.31857/S0044467722040104 EDN: PRERDC
11. Ширенова С.Д., Хлебникова Н.Н., Крупина Н.А. Экспрессия интерлейкинов IL-1β и IL-6 и рецепторов глюкокортикоидов в структурах мозга самок крыс, подвергнутых длительной социальной изоляции // Тезисы VI Международной междисциплинарной конференции “Современные проблемы системной регуляции физиологических функций”, посвященной 90-летию со дня рождения академика К.В. Судакова. Июль, 6-8, 2022. Москва. С. 552. EDN: AXFRSX
12. Ширенова С.Д., Хлебникова Н.Н., Крупина Н.А. Экспрессия рецепторов глюкокортикоидов и интерлейкинов IL-1β и IL-6 в структурах мозга крыс, подвергнутых длительной социальной изоляции: половые различия // Патогенез. 2022. Т. 20. № 3. С. 147. DOI: 10.25557/2310-0435.2022.03.147-148 EDN: LOJDAP
13. Aisa B., Gil-Bea F.J., Marcos B. et al. Neonatal stress affects vulnerability of cholinergic neurons and cognition in the rat: Involvement of the HPA axis // Psychoneuroendocrinology. 2009. V. 34. № 10. P. 1495. DOI: 10.1016/j.psyneuen.2009.05.003
14. Almulla A.F., Al-Hakeim H.K., Maes M. Chronic fatigue and affective symptoms in acute and long COVID are attributable to immune-inflammatory pathways // Psychiatry Clin. Neurosci. 2023. V. 77. № 2. P. 125. DOI: 10.1111/pcn.13514 EDN: AHRTIF
15. Barendse M.E.A., Flannery J., Cavanagh C. et al. Longitudinal change in adolescent depression and anxiety symptoms from before to during the COVID-19 pandemic // J. Res. Adolesc. 2023. V. 33. № 1. P. 74. DOI: 10.1111/jora.12781 EDN: VBQIPL
16. Barnes PJ. Glucocorticosteroids // Handb. Exp. Pharmacol. 2017. V. 237. P. 93. DOI: 10.1007/164_2016_62
17. Barrientos R., Sprunger D., Campeau S. et al. Brain-derived neurotrophic factor mRNA downregulation produced by social isolation is blocked by intrahippocampal interleukin-1 receptor antagonist // Neuroscience. 2003. V. 121. № 4. P. 847. DOI: 10.1016/s0306-4522(03)00564-5 EDN: ESAHFD
18. Belzung C., Lemoine M. Criteria of validity for animal models of psychiatric disorders: focus on anxiety disorders and depression // Biol. Mood Anxiety Disord. 2011. V. 1. № 1. P. 9. DOI: 10.1186/2045-5380-1-9 EDN: RYDBLU
19. Bianchi M., Fone K.F.C., Azmi N. et al. Isolation rearing induces recognition memory deficits accompanied by cytoskeletal alterations in rat hippocampus // Eur. J. Neurosci. 2006. V. 24. № 10. P. 2894..x. DOI: 10.1111/j.1460-9568.2006.05170
20. Bick J., Zeanah C.H., Fox N.A., Nelson C.A. Memory and executive functioning in 12-Year-old children with a history of institutional rearing // Child Dev. 2018. V. 89. P. 495. DOI: 10.1111/cdev.12952
21. Biggio F., Mostallino M.C., Talani G. et al. Social enrichment reverses the isolation-induced deficits of neuronal plasticity in the hippocampus of male rats // Neuropharmacology. 2019. V. 151. P. 45. DOI: 10.1016/j.neuropharm.2019.03.030
22. Bos K.J., Fox N., Zeanah C.H., Nelson C.A. Effects of early psychosocial deprivation on the development of memory and executive function // Front. Behav. Neurosci. 2009. V. 3. 16. DOI: 10.3389/neuro.08.016.2009
23. Braun M.D., Kisko T.M., Witt S.H. et al. Long-term environmental impact on object recognition, spatial memory, and reversal learning capabilities in Cacna1c haploinsufficient rats // Hum. Mol. Genet. 2019. V. 28. № 24. P. 4113. DOI: 10.1093/hmg/ddz235
24. Brenes J.C., Padilla M., Fornaguera J. A detailed analysis of open-field habituation and behavioral and neurochemical antidepressant-like effects in postweaning enriched rats // Behav. Brain Res. 2009. V. 197. № 1. P. 125. DOI: 10.1016/j.bbr.2008.08.014
25. Cacioppo J.T., Cacioppo S., Capitanio J.P., Cole S.W. The Neuroendocrinology of Social Isolation // Annu. Rev. Psychol. 2015. V. 66. № 1. P. 733. DOI: 10.1146/annurev-psych-010814-015240
26. Card J.P. Early experience modifies the postnatal assembly of autonomic emotional motor circuits in rats // J. Neurosci. 2005. V. 25. № 40. P. 9102. DOI: 10.1523/JNEUROSCI.2345-05.2005 EDN: LMIORR
27. Cintra A., Bhatnagar M., Chadi G. et al. Glial and neuronal glucocorticoid receptor immunoreactive cell populations in developing, adult, and aging brain // Ann. N.Y. Acad. Sci. 1994. V. 736. P. 42..x. DOI: 10.1111/j.1749-6632.1994.tb39210
28. Cole S.W., Hawkley L.C., Arevalo J.M. et al. Social regulation of gene expression in human leukocytes // Genome Biol. 2007. V. 8. R189. DOI: 10.1186/gb-2007-8-9-r189 EDN: UPBTYN
29. Cole S.W., Hawkley L.C., Arevalo J.M.G., Cacioppo J.T. Transcript origin analysis identifies antigen-presenting cells as primary targets of socially regulated gene expression in leukocytes // Proc. Natl. Acad. Sci. USA. 2011. V. 108. № 7. P. 3080. DOI: 10.1073/pnas.1014218108
30. Colvert E., Rutter M., Kreppner J. et al. Do theory of mind and executive function deficits underlie the adverse outcomes associated with profound early deprivation?: findings from the English and Romanian adoptees study // J. Abnorm. Child Psychol. 2008. V. 36. № 7. P. 1057.-x. DOI: 10.1007/s10802-008-9232 EDN: OUZDFU
31. Corsi-Zuelli F., Fachim H.A., Loureiro C.M. et al. Prolonged periods of social isolation from weaning reduce the anti-inflammatory cytokine IL-10 in blood and brain // Front. Neurosci. 2019. V. 12. 1011. DOI: 10.3389/fnins.2018.01011
32. Couzin-Frankel J. National Institutes of Health. Needed: more females in animal and cell studies // Science. 2014. V. 344. № 6185. P. 679. DOI: 10.1126/science.344.6185.679
33. Coyle C.E., Dugan E. Social isolation, loneliness and health among older adults // J. Aging Health. 2012. V. 24. № 8. P. 1346. DOI: 10.1177/0898264312460275
34. Del Arco A., Zhu S.W., Terasmaa A., Mohammed A.H., Fuxe K. Hyperactivity to novelty induced by social isolation is not correlated with changes in D2 receptor function and binding in striatum // Psychopharmacology. 2004. V. 171. P. 148. DOI: 10.1007/s00213-003-1578-8 EDN: EUMNXZ
35. Dixit N.M., Churchill A., Nsair A, Hsu J.J. Post-acute COVID-19 syndrome and the cardiovascular system: What is known? // Am. Heart. J. Plus. 2021. V. 5. 100025. DOI: 10.1016/j.ahjo.2021.100025 EDN: JFVGWH
36. Djordjevic A., Adzi M., Djordjevic J., Radojcic M.B. Stress type dependence of expression and cytoplasmic-nuclear partitioning of glucocorticoid receptor, hsp90 and hsp70 in Wistar rat brain // Neuropsychobiology. 2009. V. 59. № 4. P. 213. DOI: 10.1159/000223733 EDN: MYLPSJ
37. Dumas J.A., Newhouse P.A. The cholinergic hypothesis of cognitive aging revisited again: cholinergic functional compensation // Pharmacol. Biochem. Behav. 2011. V. 99. № 2. P. 254. DOI: 10.1016/j.pbb.2011.02.022
38. Einon D.F., Morgan M.J. A critical period for social isolation in the rat // Dev. Psychobiol. 1977. V. 10. № 2. P. 123. DOI: 10.1002/dev.420100205
39. Fone K.C.F., Porkess M.V. Behavioural and neurochemical effects of post-weaning social isolation in rodents – relevance to developmental neuropsychiatric disorders // Neurosci Biobehav Rev. 2008. V. 32. № 6. P. 1087. DOI: 10.1016/j.neubiorev.2008.03.003
40. Gamallo A., Villanua A., Trancho G., Fraile A. Stress adaptation and adrenal activity in isolated and crowded rats // Physiol. Behav. 1986. V. 36. P. 217. DOI: 10.1016/0031-9384(86)90006-5
41. Gapp K., Ziegler L., Tweedie-Cullen R.Y., Mansuy I.M. Early life epigenetic programming and transmission of stress-induced traits in mammals // BioEssays. 2014. V. 36. № 5. P. 491. DOI: 10.1002/bies.201300116
42. Garthe A., Behr J., Kempermann G. Adult-generated hippocampal neurons allow the flexible use of spatially precise learning strategies // PloS One. 2009. V. 4. № 5. e5464. DOI: 10.1371/journal.pone.0005464
43. Goel N., Workman J.L., Lee T.T., Innala L., Viau V. Sex differences in the HPA axis // Compr. Physiol. 2014. V. 4. № 3. P. 1121. DOI: 10.1002/cphy.c130054
44. Hatch A.M., Wiberg G.S., Zawidzka Z. et al. Isolation syndrome in the rat // Toxicol. Appl. Pharmacol. 1965. V. 7, № 5. P. 737. DOI: 10.1016/0041-008x(65)90132-8
45. Heidbreder C.A., Weiss I.C., Domeney A.M. et al. Behavioral, neurochemical and endocrinological characterization of the early social isolation syndrome // Neuroscience. 2000. V. 100. № 4. P. 749. DOI: 10.1016/s0306-4522(00)00336-5 EDN: AIJKTA
46. Hellemans K.G.C., Benge L.C., Olmstead M.C. Adolescent enrichment partially reverses the social isolation syndrome // Brain Res. Dev. Brain Res. 2004. V. 150. P. 103. DOI: 10.1016/j.devbrainres.2004.03.003
47. Holt-Lunstad J., Smith T.B., Layton J.B. Social relationships and mortality risk: A meta-analytic review // PLoS Medicine. 2010. V. 7. № 7. e1000316. DOI: 10.1371/journal.pmed.1000316
48. Hossain M.M., Tasnim S., Sultana A. et al. Epidemiology of mental health problems in COVID-19: A review // F1000Research. 2020. V. 9. 636. DOI: 10.12688/f1000research.24457.1 EDN: ATTYAL
49. Hueston C.M., Cryan J.F., Nolan Y.M. Adolescent social isolation stress unmasks the combined effects of adolescent exercise and adult inflammation on hippocampal neurogenesis and behavior // Neuroscience. 2017. V. 365. P. 226. DOI: 10.1016/j.neuroscience.2017.09.020
50. Ibrahim R., Abolfathi Momtaz Y., Hamid T.A. Social isolation in older Malaysians: prevalence and risk factors // Psychogeriatrics. 2013. V. 13. P. 71. DOI: 10.1111/psyg.12000
51. Ingram J., Hand C.J., Maciejewski G. Social isolation during COVID-19 lockdown impairs cognitive function // Appl. Cogn. Psychol. 2021. V. 35. № 4. P. 935. DOI: 10.1002/acp.3821 EDN: WEVCRO
52. Jang Y., Choi E.Y., Park N.S. et al. Cognitive health risks posed by social isolation and loneliness in older Korean Americans // BMC Geriatrics. 2021. V. 21. № 1. 123. DOI: 10.1186/s12877-021-02066-4 EDN: KRYTLS
53. Joyce J., Ryan J., Owen A. et al. Social isolation, social support, and loneliness and their relationship with cognitive health and dementia // Int. J. Geriatr. Psychiatry. 2022. V. 37. № 1. P. 1. DOI: 10.1002/gps.5644 EDN: GSBYVT
54. Karelina K., DeVries A.C. Modeling social influences on human health // Psychosom. Med. 2011. V. 73. № 1. P. 67. DOI: 10.1097/PSY.0b013e3182002116 EDN: OMOOUZ
55. Karpenko O., Syunyakov T.S., Kulygina M.A. et al. Impact of COVID-19 pandemic on anxiety, depression and distress –online survey results amid the pandemic in Russia // Consortium Psychiatricum. 2020. V. 1. № 1. P. 8. DOI: 10.17650/2712-7672-2020-1-1-8-20 EDN: NEQMXV
56. Khandelwal S.K., Bhatia A., Mishra A.K. Psychological adaptation of Indian expeditioners during prolonged residence in Antarctica // Indian J. Psychiatry. 2017. V. 59. P. 313. DOI: 10.4103/psychiatry.IndianJPsychiatry_296_16 EDN: YFAYVN
57. Kim Y.-K., Na K.-S., Myint A.-M., Leonard B.E. The role of pro-inflammatory cytokines in neuroinflammation, neurogenesis and the neuroendocrine system in major depression // Prog. NeuroPsychopharmacol. Biol. Psychiatry. 2016. V. 64. P. 277. DOI: 10.1016/j.pnpbp.2015.06.008
58. Ko C.Y., Liu Y.P. Disruptions of sensorimotor gating, cytokines, glycemia, monoamines, and genes in both sexes of rats reared in social isolation can be ameliorated by oral chronic quetiapine administration // Brain Behav. Immun. 2016. V. 51. P. 119. DOI: 10.1016/j.bbi.2015.08.003
59. Kokras N., Sotiropoulos I., Besinis D. et al. Neuroplasticity-related correlates of environmental enrichment combined with physical activity differ between the sexes // Eur. Neuropsychopharmacol. 2019. V. 29. № 1. P. 1. DOI: 10.1016/j.euroneuro.2018.11.1107
60. Krupina N.A., Shirenova S.D., Khlebnikova N.N. Prolonged social isolation, started early in life, impairs cognitive abilities in rats depending on sex // Brain Sci. 2020. V. 10. 799. DOI: 10.3390/brainsci10110799 EDN: JZXHSG
61. Labos E., Zabala K., Renato A. et al. Restricción cognitiva durante la cuarentena por COVID-19 [Cognitive impairment during the COVID-19- social isolation period] // Medicina (B Aires). 2021. V. 81. № 5. P. 722. PMID: 34633944. [Article in Spanish].
62. Landeiro F., Barrows P., Nuttall Musson E., Gray A.M., Leal J. Reducing social isolation and loneliness in older people: a systematic review protocol // BMJ Open. 2017. V. 7. № 5. e013778. DOI: 10.1136/bmjopen-2016-013778
63. Laws K.R., Irvine K., Gale T.M. Sex differences in cognitive impairment in Alzheimer’s disease // World J. Psychiatry. 2016. V. 6. № 1. P. 54. DOI: 10.5498/wjp.v6.i1.54
64. Lazarus R.S. Coping theory and research: past, present, and future // Psychosom. Med. 1993. V. 55. № 3. P. 234. DOI: 10.1097/00006842-199305000-00002
65. Lee C.C.E., Ali K., Connell D. et al. COVID-19-associated cardiovascular complications // Diseases. 2021. V. 9. 47. DOI: 10.3390/diseases9030047 EDN: YPNFUL
66. Leigh-Hunt N., Bagguley D., Bash K. et al. An overview of systematic reviews on the public health consequences of social isolation and loneliness // Public Health. 2017. V. 152. P. 157. DOI: 10.1016/j.puhe.2017.07.035
67. Leschak C.J., Eisenberger N. Two distinct immune pathways linking social relationships with health: Inflammatory and antiviral processes // Psychosom. Med. 2019. V. 81. P. 711. DOI: 10.1097/PSY.0000000000000685
68. Liu P.Z., Nusslock R. How stress gets under the skin: early life adversity and glucocorticoid receptor epigenetic regulation // Curr. Genomics. 2018. V.19. № 8. P. 653. DOI: 10.2174/1389202919666171228164350
69. Loftis J.M., Firsick E., Shirley K. et al. Inflammatory and mental health sequelae of COVID-19 // Compr. Psychoneuroendocrinol. 2023. V. 15. 100186. DOI: 10.1016/j.cpnec.2023.100186 EDN: WXGHVS
70. Lu L., Bao G., Chen H. et al. Modification of hippocampal neurogenesis and neuroplasticity by social environments // Exp. Neurol. 2003. V. 18. P. 600. DOI: 10.1016/s0014-4886(03)00248-6
71. Lukkes J.L., Watt M.J., Lowry C.A., Forster G.L. Consequences of post-weaning social isolation on anxiety behavior and related neural circuits in rodents // Front. Behav. Neurosci. 2009. V. 3. 18. DOI: 10.3389/neuro.08.018.2009
72. Lupien S.J., McEwen B.S., Gunnar M.R., Heim C. Effects of stress throughout the lifespan on the brain, behaviour and cognition // Nat. Rev. Neurosci. 2009. V. 10. № 6. P. 434. DOI: 10.1038/nrn2639
73. Machado I., Schiöth H.B., Lasaga M., Scimonelli T. IL-1β reduces GluA1 phosphorylation and its surface expression during memory reconsolidation and α-melanocyte-stimulating hormone can modulate these effects // Neuropharmacology. 2018. V. 128. P. 314. DOI: 10.1016/j.neuropharm.2017.09.041
74. Malcolm M., Frost H., Cowie J. Loneliness and social isolation causal association with health-related lifestyle risk in older adults: a systematic review and meta-analysis protocol // Syst. Rev. 2019. V. 8. № 48. P. 1.-x. DOI: 10.1186/s13643-019-0968
75. Mann L.M., Walker B.R. The role of equanimity in mediating the relationship between psychological distress and social isolation during COVID-19 // J. Affect. Disord. 2022. V. 296. P. 370. DOI: 10.1016/j.jad.2021.09.087 EDN: KZPMMM
76. Maslova L.N., Bulygina V.V., Amstislavskaya T.G. Prolonged social isolation and social instability in adolescence in rats: immediate and long-term physiological and behavioral effects // Neurosci. Behav. Physiol. 2010. V. 40. P. 955.-y. DOI: 10.1007/s11055-010-9352 EDN: OHPDSH
77. Matisz C.E., Badenhorst C.A., Gruber A.J. Chronic unpredictable stress shifts rat behavior from exploration to exploitation // Stress. 2021. V. 24. № 5. P. 635. DOI: 10.1080/10253890.2021.1947235 EDN: KANLJS
78. Matthews G.A., Tye K.M. Neural mechanisms of social homeostasis // Ann. N. Y. Acad. Sci. 2019. V. 1457. № 1. P. 5. DOI: 10.1111/nyas.14016 EDN: PMAAYW
79. McGaugh J.L., Roozendaal B. Role of adrenal stress hormones in forming lasting memories in the brain // Curr. Opin. Neurobiol. 2002. V. 12. P. 205. DOI: 10.1016/s0959-4388(02)00306-9
80. McIntosh A.L., Ballard T.M., Steward L.J., Moran P.M., Fone K.C.F. The atypical antipsychotic risperidone reverses the recognition memory deficits induced by post-weaning social isolation in rats // Psychopharmacology. 2013. V. 228. P. 31. DOI: 10.1007/s00213-013-3011-2 EDN: CMTCAK
81. McLaughlin K.A., Sheridan M.A., Nelson Ch.A. Neglect as a violation of species-expectant experience: Neurodevelopmental consequences // Biol. Psychiatry. 2017. V. 82. № 7. P. 462. DOI: 10.1016/j.biopsych.2017.02.1096 EDN: YEOCER
82. McLean S., Grayson B., Harris M. et al. Isolation rearing impairs novel object recognition and attentional set shifting performance in female rats // J. Psychopharmacol. 2008. V. 24. № 1. P. 57. DOI: 10.1177/0269881108093842
83. Mumtaz F., Khan M.I., Zubair M., Dehpour A.R. Neurobiology and consequences of social isolation stress in animal model – A comprehensive review // Biomed. Pharmacother. 2018. V. 105. P. 1205. DOI: 10.1016/j.biopha.2018.05.086 EDN: YJWGKL
84. Naumova O.Y., Rychkov S.Y., Kornilov S.A. et al. Effects of early social deprivation on epigenetic statuses and adaptive behavior of young children: A study based on a cohort of institutionalized infants and toddlers // PLoS One. 2019. V. 14. № 3. e0214285. DOI: 10.1371/journal.pone.0214285 EDN: WUVULD
85. Ness J.W., Marshall T.R., Aravich P.F. Effects of rearing condition on activity-induced weight loss // Dev. Psychobiol. 1995. V. 28. № 3. P. 165. DOI: 10.1002/dev.420280304
86. Noguchi T., Kubo Y., Hayashi T. et al. Social isolation and self-reported cognitive decline among older adults in Japan: A longitudinal study in the COVID-19 pandemic // J. Am. Med. Dir. Assoc. 2021. V. 22. № 7. P. 1352.e2. DOI: 10.1016/j.jamda.2021.05.015 EDN: SWAMBX
87. Nowland R., Robinson S.J., Bradley B.F., Summers V., Qualter P. Loneliness, HPA stress reactivity and social threat sensitivity: Analyzing naturalistic social challenges // Scand. J. Psychol. 2018. V. 59. № 5. P. 540. DOI: 10.1111/sjop.12461
88. Oakley R.H., Cidlowski J.A. The biology of the glucocorticoid receptor: new signaling mechanisms in health and disease // J. Allergy Clin. Immunol. 2013. V. 132. № 5. P. 1033. DOI: 10.1016/j.jaci.2013.09.007
89. Okuda S., Roozendaal B., McGaugh J.L. Glucocorticoid effects on object recognition memory require training-associated emotional arousal // Proc. Natl Acad. Sci. 2004. V. 101. № 3. P. 853. DOI: 10.1073/pnas.0307803100
90. O’Léime C.S., Cryan J.F., Nolan Y.M. Nuclear deterrents: Intrinsic regulators of IL-1β-induced effects on hippocampal neurogenesis // Brain Behav. Immun. 2017. V. 66. P. 394. DOI: 10.1016/j.bbi.2017.07.153 EDN: YDWDPV
91. Oyola M.G., Handa R.J. Hypothalamic–pituitary–adrenal and hypothalamic–pituitary–gonadal axes: Sex differences in regulation of stress responsivity // Stress. 2017. V. 20. № 5. P. 476. DOI: 10.1080/10253890.2017.1369523 EDN: YKARSO
92. Pace T.W.W., Mille A.H. Cytokines and glucocorticoid receptor signaling // Ann. N. Y. Acad. Sci. 2009. V. 1179. № 1. P. 86..x. DOI: 10.1111/j.1749-6632.2009.04984
93. Pais R., Ruano L., Moreira C. et al. Social support and cognitive impairment: results from a portuguese 4-year prospective study // Int. J. Environ. Res. Public Health. 2021. V. 18. № 16. 8841. DOI: 10.3390/ijerph18168841 EDN: TZBJOC
94. Paul S., Jeon W.K., Bizon J.L., Han J.-S. Interaction of basal forebrain cholinergic neurons with the glucocorticoid system in stress regulation and cognitive impairment // Front. Aging Neurosci. 2015. V. 7. 43. DOI: 10.3389/fnagi.2015.00043
95. Pechtel P., Pizzagalli D.A. Effects of early life stress on cognitive and affective function: an integrated review of human literature // Psychopharmacology. 2010. V. 214. P. 55. DOI: 10.1007/s00213-010-2009-2 EDN: CYCTNU
96. Perissinotto C.M., Stijacic C.I., Covinsky K.E. Loneliness in older persons // Arch. Intern. Med. 2012. V. 172. № 14. P. 1078. DOI: 10.1001/archinternmed.2012.1993
97. Perlman W.R., Webster M.J., Herman M.M., Kleinman J.E., Weickert C.S. Age-related differences in glucocorticoid receptor mRNA levels in the human brain // Neurobiol. Aging. 2007. V. 28 P. 447. DOI: 10.1016/j.neurobiolaging.2006.01.010
98. Pisu M.G., Dore R., Mostallino M.C. et al. Down-regulation of hippocampal BDNF and Arc associated with improvement in aversive spatial memory performance in socially isolated rats // Behav. Brain Res. 2011. V. 222. № 1. P. 73. DOI: 10.1016/j.bbr.2011.03.021
99. Pisu M.G., Garau A., Boero G. et al. Sex differences in the outcome of juvenile social isolation on HPA axis function in rats // Neuroscience. 2016. V. 320. P. 172. DOI: 10.1016/j.neuroscience.2016.02.009
100. Powell S.B., Swerdlow N.R., Pitcher L.K., Geyer M.A. Isolation rearing-induced deficits in prepulse inhibition and locomotor habituation are not potentiated by water deprivation // Physiol. Behav. 2002. V. 77. P. 55. -x. DOI: 10.1016/s0031-9384(02)00817
101. Pugh C., Nguyen K.T., Gonyea J.L. et al. Role of interleukin-1 beta in impairment of contextual fear conditioning caused by social isolation // Behav. Brain Res. 1999. V. 106. № 1–2. P. 109. DOI: 10.1016/s0166-4328(99)00098-4
102. Raison C.L., Capuron L., Miller A.H. Cytokines sing the blues: inflammation and the pathogenesis of depression // Trends Immunol. 2006. V. 27. № 3. P. 24. DOI: 10.1016/j.it.2005.11.006
103. Ramos-Ortolaza D.L., Doreste-Mendez R.J., Alvarado-Torres J.K., Torres-Reveron A. Ovarian hormones modify anxiety behavior and glucocorticoid receptors after chronic social isolation stress // Behav. Brain Res. 2017. V. 328. P. 115. DOI: 10.1016/j.bbr.2017.04.016
104. Rivera-Irizarry J.K., Skelly M.J., Pleil K.E. Social isolation stress in adolescence, but not adulthood, produces hypersocial behavior in adult male and female c57bl/6j mice // Front. Behav. Neurosci. 2020. V. 14. 129. DOI: 10.3389/fnbeh.2020.00129 EDN: DFGZAO
105. Rodriguez-Romaguera J., Stuber G.D. Social isolation co-opts fear and aggression circuits // Cell. 2018. V. 173. № 5. P. 1071. DOI: 10.1016/j.cell.2018.04.031
106. Rom O., Reznick A.Z. The stress reaction: A historical perspective // Adv. Exp. Med. Biol. 2015. V. 905. P. 1. DOI: 10.1007/5584_2015_195
107. Sánchez M.M., Aguado F., Sanchez-Toscano F., Saphier D. Neuroendocrine and immunocytochemical demonstrations of decreased hypothalamo-pituitary-adrenal axis responsiveness to restraint stress after long-term social isolation // Endocrinology. 1998. V. 139. P. 579. DOI: 10.1210/endo.139.2.5720
108. Sandi C., Haller J. Stress and the social brain: behavioural effects and neurobiological mechanisms // Nat. Rev. Neurosci. 2015. V. 16. № 5. P. 290. DOI: 10.1038/nrn3918
109. Sapolsky R.M., Romero L.M., Munck A.U. How do glucocorticoids influence stress responses? Integrating permissive, suppressive, stimulatory, and preparative actions // Endocr. Rev. 2000. V. 21. № 1. P. 55. DOI: 10.1210/edrv.21.1.0389
110. Schrijver N.C.A., Bahr N.I., Weiss I.C., Wurbel H. Dissociable effects of isolation rearing and environmental enrichment on exploration, spatial learning and HPA activity in adult rats // Pharmacol. Biochem. Behav. 2002. V. 73. P. 209. DOI: 10.1016/s0091-3057(02)00790-6
111. Schrijver N.C.A., Wurbel H. Early social deprivation disrupts attentional, but not affective, shifts in rats // Behav. Neurosci. 2001. V. 115. № 2. P. 437. PMID: 11345968. EDN: GBBQGE
112. Schweinfurth M.K. The social life of Norway rats (Rattus norvegicus) // Elife. 2020. V. 9. e54020. DOI: 10.7554/eLife.54020 EDN: DXFDNX
113. Seillier A., Giuffrida A. Disruption of social cognition in the sub-chronic PCP rat model of schizophrenia: Possible involvement of the endocannabinoid system // Eur. Neuropsychopharmacol. 2016. V. 26. № 2. P. 298. DOI: 10.1016/j.euroneuro.2015.12.009
114. Serra M., Pisu M.G., Floris I., Biggio G. Social isolation-induced changes in the hypothalamic–pituitary–adrenal axis in the rat // Stress. 2005. V. 8. P. 259. DOI: 10.1080/10253890500495244
115. Shirenova S.D., Khlebnikova N.N., Krupina N.A. Glucocorticoid receptor expression in brain structures of socially isolated rats // “2nd Clinical neurology and neurosurgery congress”. Berlin, July 15-16, 2021. P. 10. EDN: TOBDAU
116. Slavich G.M., Irwin M.R. From stress to inflammation and major depressive disorder: a social signal transduction theory of depression // Psychol. Bull. 2014. V. 140. № 3. P. 774. DOI: 10.1037/a0035302
117. Smith K.E., Pollak S.D. Early life stress and perceived social isolation influence how children use value information to guide behavior // Child Dev. 2022. V. 93. № 3. P. 804. DOI: 10.1111/cdev.13727 EDN: QHYYUY
118. Snyder-Mackler N., Burger J.R., Gaydosh L. et al. Social determinants of health and survival in humans and other animals // Science. 2020. V. 368. № 6493. eaax9553. DOI: 10.1126/science.aax9553 EDN: PBBBCD
119. Spear L.P. The adolescent brain and age-related behavioral manifestations // Neurosci. Biobehav. Rev. 2000. V. 24. P. 417. DOI: 10.1016/s0149-7634(00)00014-2 EDN: MAENOV
120. Syme L.A. Social isolation at weaning: Some effects on two measures of activity // Animal Learning & Behavior. 1973. V. 1. P. 161. DOI: 10.3758/BF03199065
121. Toyoshima M., Yamada K., Sugita M., Ichitani Y. Social enrichment improves social recognition memory in male rats // Anim. Cogn. 2018. V. 21. № 3. P. 345. DOI: 10.1007/s10071-018-1171-5 EDN: LLJPFF
122. Turner A.I., Smyth N., Hall S.J. et al. Psychological stress reactivity and future health and disease outcomes: A systematic review of prospective evidence // Psychoneuroendocrinology. 2020. V. 114. 104599. DOI: 10.1016/j.psyneuen.2020.104599 EDN: OZNWST
123. van Ijzendoorn M.H., Luijk M.P.C.M, Juffer F. IQ of children growing up in children’s homes: A meta-analysis on IQ delays in orphanages // Merrill-Palmer Quarterly. 2008. V. 54. № 3. P. 341. DOI: 10.1353/mpq.0.0002
124. Victor C.R., Scambler S.J., Bowling A., Bond J. The prevalence of, and risk factors for, loneliness in later life: a survey of older people in Great Britain // Ageing and Society. 2005. V. 25. № 6. P. 357. DOI: 10.1017/s0144686x04003332 EDN: GRVDNT
125. Vitellius G., Trabado S., Bouligand J., Delemer B., Lombès M. Pathophysiology of glucocorticoid signaling // Annales d’Endocrinologie. 2018. V. 79. № 3. P. 98. DOI: 10.1016/j.ando.2018.03.001
126. Viveros M.P., Hernandez R., Gallego A. Effects of social isolation and crowding upon active-avoidance performance in the rat // Animal Learning & Behavior. 1990. V. 18. № 1. P. 90. DOI: 10.3758/bf03205243
127. Vorhees C.V., Williams M.T. Assessing spatial learning and memory in rodents // ILAR Journal. 2014. V. 55. № 2. P. 310. DOI: 10.1093/ilar/ilu013
128. Walker D.M., Cunningham A.M., Gregory J.K., Nestler E.J. Long-term behavioral effects of post-weaning social isolation in males and females // Front. Behav. Neurosci. 2019. V. 13. 66. DOI: 10.3389/fnbeh.2019.00066
129. Weiss I.C., Pryce C.R., Jongen-Rêlo A.L., Nanz-Bahr N.I., Feldon J. Effect of social isolation on stress-related behavioural and neuroendocrine state in the rat // Behav. Brain Res. 2004. V. 152. № 2. P. 279. DOI: 10.1016/j.bbr.2003.10.015
130. Welzel F.D., Schladitz K., Förster F., Löbner M., Riedel-Heller S.G. Gesundheitliche Folgen sozialer Isolation: Qualitative Studie zu psychosozialen Belastungen und Ressourcen älterer Menschen im Zusammenhang mit der COVID-19-Pandemie [Health-related consequences of social isolation: a qualitative study on psychosocial stress and resources among older adults in the COVID-19 pandemic] // Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz. 2021. V. 64. № 3. P. 334. [Article in German]. DOI: 10.1007/s00103-021-03281-5 EDN: URLYLE
131. Wongwitdecha N., Marsden C. Social isolation increases aggressive behaviour and alters the effects of diazepam in the rat social interaction test // Behav. Brain Res. 1996. V. 75. P. 27. DOI: 10.1016/0166-4328(96)00181-7
132. Xia N., Li H. Loneliness, social isolation, and cardiovascular health // Antioxid. Redox Signal. 2018. V. 28. № 9. P. 837. DOI: 10.1089/ars.2017.7312 EDN: YGZTBB
133. Yazdanfar N., Ali Mard S., Mahmoudi J. et al. Maternal morphine exposure and post-weaning social isolation impair memory and ventral striatum dopamine system in male offspring: Is an enriched environment beneficial? // Neuroscience. 2021. V. 461. P. 80. DOI: 10.1016/j.neuroscience.2021.02.024 EDN: YXPZZX
134. Yu B., Steptoe A., Chen Y., Jia X. Social isolation, rather than loneliness, is associated with cognitive decline in older adults: the China health and retirement longitudinal study // Psychol. Med. 2021. V. 51. № 14. P. 2414. DOI: 10.1017/S0033291720001014 EDN: CVCUXI
Выпуск
Другие статьи выпуска
Фактор роста фибробластов (FGF21) является гормоном печени, который способствует адаптации организма к различным ситауциям, вызывающим напряжение систем метаболизма. В обзоре рассмотрены некоторые нерешенные вопросы, касающиеся физиологического действия этого уникального метаболического регулятора, суммированы основные знания о фармакологических свойствах FGF21 и освещены половые различия в их проявлении при коррекции ожирения. Обобщены результаты, показывающие, что эффективность использования FGF21 для терапии ожирения зависит от этиологии ожирения и пола. Подчеркивается необходимость исследования механизмов возникновения половых различий действия FGF21 для его успешного использования при лечении ожирения у особей мужского и женского пола.
Сладкое – наиболее сильная вкусовая модальность, формирующая пищевое поведение и влияющая на гомеостаз. В обзоре суммированы сведения о рецепции и кодировании вкусовых сигналов на уровне вкусовых почек и центров головного мозга при потреблении сладких веществ. Основное внимание уделено молекулярно-клеточным механизмам идентификации сладкого вкуса и детекции калорийного состава пищи, включая роль мембранных белковых рецепторов T1R2/T1R3 и связанного с ними внутриклеточного ферментативного каскада, а также метаболического механизма оценки концентрации поступающей в цитоплазму глюкозы. Описаны генетические аспекты чувствительности к сладкому и влияние полиморфизма генов рецептора сладкого вкуса на чувствительность к сахарам и низкокалорийным сахарозаменителям. В обзоре приведены результаты современных исследований эндокринной, паракринной и аутокринной модуляции рецепции и восприятия сладкого вкуса в зависимости от метаболического статуса организма. Сделано предположение о перспективном направлении исследований по проблеме.
Кортикотропин-рилизинг фактор (КРФ) и капсаицин-чувствительные афферентные нейроны с эфферентно-подобной функцией (КЧН) вносят важный вклад в регуляцию функций желудочно-кишечного тракта (ЖКТ) и гастропротекцию. Цель обзора заключалась в анализе данных литературы, в том числе и результатов собственных исследований, о взаимодействии КРФ и КЧН в обеспечении гастропротекции и регуляции функций ЖКТ, с фокусом на наиболее изученное их взаимодействие в регуляции моторной функции ЖКТ. На основании результатов исследований авторов обзора обсуждается возможность вклада КЧН в реализацию гастропротективного влияния КРФ и, наоборот, возможность участия КРФ в обеспечении гастропротективного действия капсацина, активирующего КЧН. Рассматривается вклад глюкокортикоидных гормонов в реализацию гастропротективного действия КРФ и компенсаторная гастропротективная роль данных гормонов в условиях выключения из функционирования КЧН.
Согласно современным представлениям, основу интеллектуальных проблем при нейрологических повреждениях мозга составляет активное забывание, регулируемое зависимыми от малых ГТФаз Rac и Rho сигнальными каскадами ремоделирования актина. Ключевой фермент этих каскадов – LIM-киназа 1 (LIMK1). Изменения экспрессии гена limk1 приводят к нейрокогнитивным патологиям. Для экспресс-скрининга и тестирования агентов целенаправленного терапевтического воздействия, изменяющих белок-белковые взаимодействия ГТФаз и компонентов сигнальных каскадов, необходимо создание и валидация простых животных моделей. Такую возможность предоставляет дрозофила, мутантные линии которой позволяют выявить узловые моменты пересечений биохимических и нервных сетей, сопровождающие активное забывание.
В обзоре представлены данные последних лет о восстановлении двигательных функций после спинальных травм: о спонтанной нейропластичности; о пластичности, зависящей от физической активности; о результатах использования эпидуральной и чрескожной электростимуляции спинного мозга для восстановления контроля движений; о нейрофизиологических изменениях и механизмах, инициируемых спинальной электростимуляцией, которые, возможно, способствуют функциональному восстановлению после травм спинного мозга.
Статистика статьи
Статистика просмотров за 2025 - 2026 год.
Издательство
- Издательство
- ИЗДАТЕЛЬСТВО НАУКА
- Регион
- Россия, Москва
- Почтовый адрес
- 121099 г. Москва, Шубинский пер., 6, стр. 1
- Юр. адрес
- 121099 г. Москва, Шубинский пер., 6, стр. 1
- ФИО
- Николай Николаевич Федосеенков (Директор)
- E-mail адрес
- info@naukapublishers.ru
- Контактный телефон
- +7 (495) 2767735