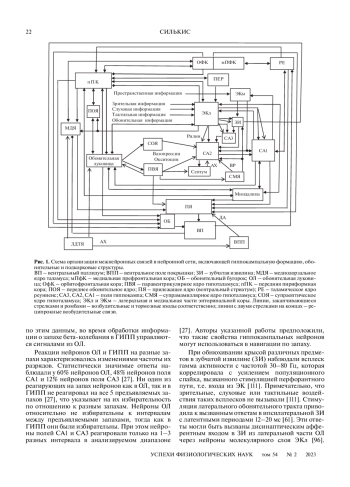
Предложен механизм взаимозависимого функционирования обонятельной и гиппокампальной нейронных сетей. В этом функционировании существенную роль играют длительные изменения эффективности связей между нейронами из этих сетей, а также из вентральной части базальных ганглиев, фронтальных областей коры, таламических ядер реуниенс и медиодорзального. Запахи участвуют в пространственном картировании и навигации, поскольку эти два вида информации обрабатываются одновременно и взаимозависимо. Предложенный механизм формирования отображений ассоциаций “запах–объект–место” в активности нейронов из разных полей гиппокампа может лежать в основе участия запахов в определении “полей места”. Поле СА2 гиппокампа вносит важный вклад в этот процесс, способствуя запоминанию и извлечению из памяти информации, связанной с запахами и с их расположением. Благодаря гиппокампальным проекциям в обонятельные структуры, в активности нейронов пириформной коры также формируются пространственные отображения окружающей среды. Согласно предлагаемому механизму, повреждения различных звеньев анализируемых цепей, как и ослабление нейрогенеза в зубчатой извилине и обонятельной луковице, должны ухудшать обоняние и память на запахи. Это следствие согласуется с обонятельным дефицитом при различных нейродегенеративных и вирусных заболеваниях, а также при старении.
Идентификаторы и классификаторы
- SCI
- Биология
Участие памяти чрезвычайно важно для идентификации и оценки запахов [116]. Ранее полагали, что гиппокамп (ГИПП) предпочтительно участвует не в запоминании отдельных запахов, а в кодировании отношений между ними и запоминании нейронных отображений запахов в новых ситуациях [28, 73].
Список литературы
1. Силькис И.Г. Участие трисинаптического гиппокампального пути в формировании нейронных отображений ассоциаций “объект–место” (аналитический обзор) // Журн. высш. нерв. деят. 2009. Т. 59. № 6. С. 645. EDN: KYGGOJ
2. Силькис И.Г. О роли базальных ганглиев в обработке сложных звуковых стимулов и слуховом внимании // Успехи физиол. наук. 2015. Т. 46. № 3. С. 76. EDN: UJLAVX
3. Силькис И.Г. Участие ядер гипоталамуса в формировании ассоциаций объект-место на нейронах поля СА2 гиппокампа (гипотетический механизм) // Журн. высш. нерв. деят. 2021. № 71. № 2. С. 147. DOI: 10.31857/S0044467721020106 EDN: OPMMCQ
4. Силькис И.Г. О сходстве механизмов обработки обонятельной, слуховой и зрительной информации в ЦНС (Гипотеза) // Нейрохимия. 2023. Т. 40. № 1. С. 1. DOI: 10.31857/S1027813323010193 EDN: ERMMSU
5. Aikath D., Weible A.P., Rowland D.C., Kentros C.G. Role of self-generated odor cues in contextual representation // Hippocampus. 2014. V. 24. № 8. P. 1039. DOI: 10.1002/hipo.22289
6. Aimone J.B., Deng W., Gage F.H. Resolving new memories: a critical look at the dentate gyrus, adult neurogenesis, and pattern separation // Neuron. 2011. V. 70. № 4. P. 589. DOI: 10.1016/j.neuron.2011.05.010
7. Alexander G.M., Farris S., Pirone J.R. et al. Social and novel contexts modify hippocampal CA2 representations of space // Nat. Commun. 2016. V. 7. P. 10300. DOI: 10.1038/ncomms10300
8. Aqrabawi A.J., Kim J.C. Olfactory memory representations are stored in the anterior olfactory nucleus // Nat. Commun. 2020. V. 11. № 1. P. 1246. DOI: 10.1038/s41467-020-15032-2 EDN: HZASYY
9. Aqrabawi A.J., Kim J.C. Hippocampal projections to the anterior olfactory nucleus differentially convey spatiotemporal information during episodic odour memory // Nat. Commun. 2018. V. 9. № 1. P. 2735. DOI: 10.1038/s41467-018-05131-6 EDN: DMTSLU
10. Bannert M.M., Bartels A. Human V4 Activity Patterns Predict Behavioral Performance in Imagery of Object Color // J. Neurosci. 2018. V. 38. № 15. P. 3657. DOI: 10.1523/JNEUROSCI.2307-17.2018
11. Bayat A.H., Azimi H., Hassani Moghaddam M. et al. COVID-19 causes neuronal degeneration and reduces neurogenesis in human hippocampus // Apoptosis. 2022. V. 27. № 11-12. P. 852. DOI: 10.1007/s10495-022-01754-9 EDN: ICJJPZ
12. Benoy A., Dasgupta A., Sajikumar S. Hippocampal area CA2: an emerging modulatory gateway in the hippocampal circuit // Exp. Brain Res. 2018. V. 236. № 4. P. 919. DOI: 10.1007/s00221-018-5187-5 EDN: HIRJBT
13. Bhasin G., Nair I.R. Dynamic Hippocampal CA2 Responses to Contextual Spatial Novelty // Front. Syst. Neurosci. 2022. V. 16. P. 923911. DOI: 10.3389/fnsys.2022.923911 EDN: UXGNBP
14. Biella G., de Curtis M. Olfactory inputs activate the medial entorhinal cortex via the hippocampus // J. Neurophysiol. 2000. V. 83. № 4. P. 1924. DOI: 10.1152/jn.2000.83.4.1924 EDN: QIGTXV
15. Bitter T., Siegert F., Gudziol H. et al. Gray matter alterations in parosmia // Neuroscience. 2011. V. 177. P. 177. DOI: 10.1016/j.neuroscience.2011.01.016
16. Bitzenhofer S.H., Westeinde E.A., Zhang H.B., Isaacson J.S. Rapid odor processing by layer 2 subcircuits in lateral entorhinal cortex // Elife. 2022. V. 11. e75065. DOI: 10.7554/eLife.75065 EDN: LRPZGX
17. Boesveldt S., de Muinck Keizer R.J., Wolters E.Ch., Berendse H.W. Odor recognition memory is not independently impaired in Parkinson’s disease // J. Neural Transm. (Vienna). 2009. V. 116. № 5. P. 575. -y. DOI: 10.1007/s00702-009-0208
18. Cassano T., Romano A., Macheda T. et al. Olfactory memory is impaired in a triple transgenic model of Alzheimer disease // Behav. Brain Res. 2011. V. 224. № 2. P. 408. DOI: 10.1016/j.bbr.2011.06.029 EDN: PHBPHT
19. Cenquizca L.A., Swanson L.W. Spatial organization of direct hippocampal field CA1 axonal projections to the rest of the cerebral cortex // Brain Res. Rev. 2007. V. 56. № 1. P. 1. DOI: 10.1016/j.brainresrev.2007.05.002
20. Chaillan F.A., Roman F.S., Soumireu-Mourat B. Modulation of synaptic plasticity in the hippocampus and piriform cortex by physiologically meaningful olfactory cues in an olfactory association task // J. Physiol. Paris. 1996. V. 90. № 5–6. P. 343. DOI: 10.1016/s0928-4257(97)87916-8
21. Chapuis J., Cohen Y., He X. et al. Lateral entorhinal modulation of piriform cortical activity and fine odor discrimination // J. Neurosci. 2013. V. 33. № 33. P. 13449. DOI: 10.1523/JNEUROSCI.1387-13.2013
22. Chevaleyre V., Siegelbaum S.A. Strong CA2 pyramidal neuron synapses define a powerful disynaptic cortico-hippocampal loop // Neuron. 2010. V. 66. № 4. P. 560. DOI: 10.1016/j.neuron.2010.04.013
23. Dahmani L., Patel R.M., Yang Y. et al. An intrinsic association between olfactory identification and spatial memory in humans // Nat. Commun. 2018. V. 9. № 1. P. 4162. DOI: 10.1038/s41467-018-06569-4 EDN: SUISLV
24. Dasgupta A., Baby N., Krishna K. et al. Substance P induces plasticity and synaptic tagging/capture in rat hippocampal area CA2 // Proc. Natl. Acad. Sci. USA. 2017. V. 114. № 41. P. E8741. DOI: 10.1073/pnas.1711267114
25. Datiche F., Luppi P.H., Cattarelli M. Projection from nucleus reuniens thalami to piriform cortex: a tracing study in the rat // Brain Res. Bull. 1995. V. 38. № 1. P. 87. -p. DOI: 10.1016/0361-9230(95)00075 EDN: APKRUR
26. De La Rosa-Prieto C., De Moya-Pinilla M., Saiz-Sanchez D. et al. Olfactory and cortical projections to bulbar and hippocampal adult-born neurons // Front. Neuroanat. 2015. V. 9. P. 4. DOI: 10.3389/fnana.2015.00004 EDN: YBFNUH
27. Deshmukh S.S., Bhalla U.S. Representation of odor habituation and timing in the hippocampus // J. Neurosci. 2003. V. 23. № 5. P. 1903. DOI: 10.1523/JNEUROSCI.23-05-01903.2003
28. Eichenbaum H. Using olfaction to study memory // Ann. NY Acad. Sci. 1998. V. 855. P. 657. x. DOI: 10.1111/j.1749-6632.1998.tb10642
29. Eichenbaum H., Robitsek R.J. Olfactory memory: a bridge between humans and animals in models of cognitive aging // Ann. NY Acad. Sci. 2009. V. 1170. P. 658. x. DOI: 10.1111/j.1749-6632.2009.04012
30. Ferraris M., Cassel J.C., Pereira de Vasconcelos A., Stephan A., Quilichini P.P. The nucleus reuniens, a thalamic relay for cortico-hippocampal interaction in recent and remote memory consolidation // Neurosci. Biobehav. Rev. 2021. V. 125. P. 339. DOI: 10.1016/j.neubiorev.2021.02.025 EDN: SOEULZ
31. Fischler-Ruiz W., Clark D.G., Joshi N.R. et al. Olfactory landmarks and path integration converge to form a cognitive spatial map // Neuron. 2021. V. 109. № 24. P. 4036. e5. DOI: 10.1016/j.neuron.2021.09.055 EDN: LJIQIN
32. Galliot E., Comte A., Magnin E. et al. Effects of an ambient odor on brain activations during episodic retrieval of objects // Brain Imaging Behav. 2013. V. 7. № 2. P. 213. DOI: 10.1007/s11682-012-9218-8
33. Ge S., Yang C.H., Hsu K.S., Ming G.L., Song H. A critical period for enhanced synaptic plasticity in newly generated neurons of the adult brain // Neuron. 2007. V. 54. № 4. P. 559. DOI: 10.1016/j.neuron.2007.05.002
34. Gilbert P.E., Pirogovsky E., Ferdon S., Brushfield A.M., Murphy C. Differential effects of normal aging on memory for odor-place and object-place associations // Exp. Aging Res. 2008. V. 34. № 4. P. 437. DOI: 10.1080/03610730802271914
35. Gnatkovsky V., Uva L., de Curtis M. Topographic distribution of direct and hippocampus-mediated entorhinal cortex activity evoked by olfactory tract stimulation // Eur. J. Neurosci. 2004. V. 20. № 7. P. 1897. x. DOI: 10.1111/j.1460-9568.2004.03627
36. Goodrich-Hunsaker N.J., Gilbert P.E., Hopkins R.O. The role of the human hippocampus in odor-place associative memory // Chem. Senses. 2009. V. 34. № 6. P. 513. DOI: 10.1093/chemse/bjp026
37. Gottfried J.A., Smith A.P., Rugg M.D., Dolan R.J. Remembrance of odors past: human olfactory cortex in cross-modal recognition memory // Neuron. 2004. V. 42. № 4. P. 687. DOI: 10.1016/s0896-6273(04)00270-3
38. Gourévitch B., Kay L.M., Martin C. Directional coupling from the olfactory bulb to the hippocampus during a go/no-go odor discrimination task // J. Neurophysiol. 2010. V. 103. № 5. P. 2633. DOI: 10.1152/jn.01075.2009 EDN: NZPHQX
39. Grella S.L., Fortin A.H., McKissick O., Leblanc H., Ramirez S. Odor modulates the temporal dynamics of fear memory consolidation // Learn. Mem. 2020. V. 27. № 4. P. 150. DOI: 10.1101/lm.050690.119 EDN: BPISVW
40. Hanson E., Swanson J., Arenkiel B.R. Sensory experience shapes the integration of adult-born neurons into the olfactory bulb // J. Nat. Sci. 2017. V. 3. № 8. P. e422.
41. Hitti F.L., Siegelbaum S.A. The hippocampal CA2 region is essential for social memory // Nature. 2014. V. 508. № 7494. P. 88. DOI: 10.1038/nature13028
42. Huang C.C., Rolls E.T., Hsu C.H., Feng J., Lin C.P. Extensive Cortical Connectivity of the Human Hippocampal Memory System: Beyond the “What” and “Where” Dual Stream Model // Cereb. Cortex. 2021. V. 31. № 10. P. 4652. DOI: 10.1093/cercor/bhab113 EDN: CFFCTU
43. Insausti R., Marcos P., Arroyo-Jiménez M.M., Blaizot X., Martínez-Marcos A. Comparative aspects of the olfactory portion of the entorhinal cortex and its projection to the hippocampus in rodents, nonhuman primates, and the human brain // Brain Res. Bull. 2002. V. 57. № 3–4. P. 557. DOI: 10.1016/s0361-9230(01)00684-0
44. Jaako-Movits K., Zharkovsky A. Impaired fear memory and decreased hippocampal neurogenesis following olfactory bulbectomy in rats // Eur. J. Neurosci. 2005. V. 22. № 11. P. 2871. x. DOI: 10.1111/j.1460-9568.2005.04481
45. Jones-Gotman M., Zatorre R.J. Odor recognition memory in humans: role of right temporal and orbitofrontal regions // Brain Cogn. 1993. V. 22. № 2. P. 182. DOI: 10.1006/brcg.1993.1033
46. Jorge P.E., Phillips J.B., Gonçalves A., Marques P.A., Nĕmec P. Odours stimulate neuronal activity in the dorsolateral area of the hippocampal formation during path integration // Proc. Biol. Sci. 2014. V. 281. № 1783. P. 20140025. DOI: 10.1098/rspb.2014.0025
47. Kazarian A.L., Hekimian A.A., Harutiunian-Kozak B.A. et al. Responses of cat’s dorsal hippocampal neurones to moving visual stimuli // Acta. Neurobiol. Exp. (Wars). 1995. V. 55. № 2. P. 99. EDN: XIZCZV
48. Kesner R.P., Hunsaker M.R., Ziegler W. The role of the dorsal and ventral hippocampus in olfactory working memory // Neurobiol. Learn. Mem. 2011. V. 96. № 2. P. 361. DOI: 10.1016/j.nlm.2011.06.011
49. Kim W.B., Cho J.H. Synaptic Targeting of Double-Projecting Ventral CA1 Hippocampal Neurons to the Medial Prefrontal Cortex and Basal Amygdala // J. Neurosci. 2017. V. 37. № 19. P. 4868. DOI: 10.1523/JNEUROSCI.3579-16.2017
50. Kjelvik G., Evensmoen H.R., Brezova V., Håberg A.K. The human brain representation of odor identification // J. Neurophysiol. 2012. V. 108. № 2. P. 645. DOI: 10.1152/jn.01036.2010
51. Knafo S., Ariav G., Barkai E., Libersat F. Olfactory learning-induced increase in spine density along the apical dendrites of CA1 hippocampal neurons // Hippocampus. 2004. V. 14. № 7. P. 819. DOI: 10.1002/hipo.10219 EDN: LTTMVR
52. Künzle H. An extrahippocampal projection from the dentate gyrus to the olfactory tubercle // BMC Neurosci. 2005. V. 6. P. 38. DOI: 10.1186/1471-2202-6-38 EDN: TJPDOX
53. Lavenex P., Amaral D.G. Hippocampal-neocortical interaction: a hierarchy of associativity // Hippocampus. 2000. V. 10. № 4. P.420. 3.0.CO;2-5“ xmlns:xlink=“http://www.w3.org/1999/xlink”>. DOI: 10.1002/1098-1063(2000)10:43.0.CO;2-5
54. Lebedev M.A., Ossadtchi A. Commentary: Spatial Olfactory Learning Contributes to Place Field Formation in the Hippocampus // Front. Syst. Neurosci. 2018. V. 12. P. 8. DOI: 10.3389/fnsys.2018.00008 EDN: YCHKSL
55. Lehr A.B., Kumar A., Tetzlaff C., Hafting T., Fyhn M., Stöber T.M. CA2 beyond social memory: Evidence for a fundamental role in hippocampal information processing // Neurosci. Biobehav. Rev. 2021. V. 126. P. 398. DOI: 10.1016/j.neubiorev.2021.03.020 EDN: EQAHMV
56. Leitner F.C., Melzer S., Lütcke H. et al. Spatially segregated feedforward and feedback neurons support differential odor processing in the lateral entorhinal cortex // Nat. Neurosci. 2016. V. 19. № 7. P. 935. DOI: 10.1038/nn.4303
57. Levinson M., Kolenda J.P., Alexandrou G.J. et al. Context-dependent odor learning requires the anterior olfactory nucleus // Behav. Neurosci. 2020. V. 134. № 4. P. 332. DOI: 10.1037/bne0000371 EDN: ZEJIDW
58. Levy D.A., Hopkins R.O., Squire L.R. Impaired odor recognition memory in patients with hippocampal lesions // Learn. Mem. 2004. V. 11. № 6. P. 794. DOI: 10.1101/lm.82504
59. Li Y., Xu J., Liu Y. et al. A distinct entorhinal cortex to hippocampal CA1 direct circuit for olfactory associative learning // Nat. Neurosci. 2017. V. 20. № 4. P. 559. DOI: 10.1038/nn.4517
60. Linley S.B., Gallo M.M., Vertes R.P. Lesions of the ventral midline thalamus produce deficits in reversal learning and attention on an odor texture set shifting task // Brain Res. 2016. V. 1649. Pt. A. P. 110. DOI: 10.1016/j.brainres.2016.08.022
61. Liu P., Bilkey D.K. Parallel involvement of perirhinal and lateral entorhinal cortex in the polysynaptic activation of hippocampus by olfactory inputs // Hippocampus. 1997. V. 7. № 3. P. 296. 3.0.CO;2-J“ xmlns:xlink=“http://www.w3.org/1999/xlink”>-J. DOI: 10.1002/(SICI)1098-1063(1997)7:33.0.CO;2
62. Lunardi P., Mansk L.M.Z., Jaimes L.F., Pereira G.S. On the novel mechanisms for social memory and the emerging role of neurogenesis // Brain Res. Bull. 2021. V. 171. P. 56. DOI: 10.1016/j.brainresbull.2021.03.006 EDN: YMQZUG
63. Ma D.K., Kim W.R., Ming G.L., Song H. Activity-dependent extrinsic regulation of adult olfactory bulb and hippocampal neurogenesis // Ann. NY Acad. Sci. 2009. V. 1170. P. 664. x. DOI: 10.1111/j.1749-6632.2009.04373
64. Ma Q., Rolls E.T., Huang C.C., Cheng W., Feng J. Extensive cortical functional connectivity of the human hippocampal memory system // Cortex. 2022. V. 147. P. 83. DOI: 10.1016/j.cortex.2021.11.014 EDN: UBPNIC
65. MacDonald C.J., Carrow S., Place R., Eichenbaum H. Distinct hippocampal time cell sequences represent odor memories in immobilized rats // J. Neurosci. 2013. V. 33. P. 14607. DOI: 10.1523/JNEUROSCI.1537-13.2013
66. Mankin E.A., Diehl G.W., Sparks F.T., Leutgeb S., Leutgeb J.K. Hippocampal CA2 activity patterns change over time to a larger extent than between spatial contexts // Neuron. 2015. V. 85. № 1. P. 190. DOI: 10.1016/j.neuron.2014.12.001
67. Masurkar A.V., Srinivas K.V., Brann D.H. et al. Medial and Lateral Entorhinal Cortex Differentially Excite Deep versus Superficial CA1 Pyramidal Neurons // Cell Rep. 2017. V. 18. № 1. P. 148. DOI: 10.1016/j.celrep.2016.12.012
68. Middleton S.J., McHugh T.J. CA2: A Highly Connected Intrahippocampal Relay // Annu. Rev. Neurosci. 2020. V. 43. P. 55. DOI: 10.1146/annurev-neuro-080719-100343 EDN: KIOFYK
69. Mouly A.M., Di Scala G. Entorhinal cortex stimulation modulates amygdala and piriform cortex responses to olfactory bulb inputs in the rat // Neuroscience. 2006. V. 137. № 4. P. 1131. DOI: 10.1016/j.neuroscience.2005.10.024
70. Murray E.A., Wise S.P., Graham K.S. Representational specializations of the hippocampus in phylogenetic perspective // Neurosci. Lett. 2018. V. 680. P. 4. DOI: 10.1016/j.neulet.2017.04.065
71. Naber P.A., Lopes da Silva F.H., Witter M.P. Reciprocal connections between the entorhinal cortex and hippocampal fields CA1 and the subiculum are in register with the projections from CA1 to the subiculum // Hippocampus. 2001. V. 11. № 2. P. 99. DOI: 10.1002/hipo.1028
72. Nordin S., Murphy C. Odor memory in normal aging and Alzheimer’s disease // Ann. NY Acad. Sci. 1998. V. 855. P. 686. x. DOI: 10.1111/j.1749-6632.1998.tb10646
73. Otto T., Schottler F., Staubli U., Eichenbaum H., Lynch G. Hippocampus and olfactory discrimination learning: effects of entorhinal cortex lesions on olfactory learning and memory in a successive-cue, go-no-go task // Behav. Neurosci. 1991. V. 105. № 1. P. 111. DOI: 10.1037//0735-7044.105.1.111
74. Pang C.C., Kiecker C., O’Brien J.T., Noble W., Chang R.C. Ammon’s Horn 2 (CA2) of the Hippocampus: A Long-Known Region with a New Potential Role in Neurodegeneration // Neuroscientist. 2019. V. 25. № 2. P. 167. DOI: 10.1177/1073858418778747
75. Pereira-Caixeta A.R., Guarnieri L.O., Medeiros D.C. et al. Inhibiting constitutive neurogenesis compromises long-term social recognition memory // Neurobiol. Learn. Mem. 2018. V. 155. P. 92. DOI: 10.1016/j.nlm.2018.06.014
76. Persson B.M., Ambrozova V., Duncan S. et al. Lateral entorhinal cortex lesions impair odor-context associative memory in male rats // J. Neurosci. Res. 2022. V. 100. № 4. P. 1030. DOI: 10.1002/jnr.25027 EDN: TPHPQV
77. Phillipson O.T., Griffiths A.C. The topographic order of inputs to nucleus accumbens in the rat // Neuroscience. 1985. V. 16. № 2. P. 275. DOI: 10.1016/0306-4522(85)90002-8
78. Poo C., Agarwal G., Bonacchi N., Mainen Z.F. Spatial maps in piriform cortex during olfactory navigation // Nature. 2022. V. 601. № 7894. P. 595. DOI: 10.1038/s41586-021-04242-3 EDN: UULMSA
79. Radhakrishnan R.K., Kandasamy M. SARS-CoV-2-Mediated Neuropathogenesis, Deterioration of Hippocampal Neurogenesis and Dementia // Am. J. Alzheimers Dis. Other Demen. 2022. V. 37. P. 15333175221078418. DOI: 10.1177/15333175221078418 EDN: DSBDYD
80. Radvansky B.A., Oh J.Y., Climer J.R., Dombeck D.A. Behavior determines the hippocampal spatial mapping of a multisensory environment // Cell Rep. 2021. V. 36. № 5. P. 109444. DOI: 10.1016/j.celrep.2021.109444 EDN: GKFIDK
81. Ramus S.J., Davis J.B., Donahue R.J., Discenza C.B., Waite A.A. Interactions between the orbitofrontal cortex and the hippocampal memory system during the storage of long-term memory // Ann. NY Acad. Sci. 2007. V. 1121. P. 216. DOI: 10.1196/annals.1401.038
82. Rethinavel H.S., Ravichandran S., Radhakrishnan R.K., Kandasamy M. COVID-19 and Parkinson’s disease: Defects in neurogenesis as the potential cause of olfactory system impairments and anosmia // J. Chem. Neuroanat. 2021. V. 115. P. 101965. DOI: 10.1016/j.jchemneu.2021.101965 EDN: OMNFNG
83. Riceberg J.S., Srinivasan A., Guise K.G., Shapiro M.L. Hippocampal signals modify orbitofrontal representations to learn new paths // Curr. Biol. 2022. V. 32. № 15. P. 3407.e6. DOI: 10.1016/j.cub.2022.06.010 EDN: EFFFBI
84. Robert V., Therreau L., Chevaleyre V. et al. Local circuit allowing hypothalamic control of hippocampal area CA2 activity and consequences for CA1 // Elife. 2021. V. 10. P. e63352. DOI: 10.7554/eLife.63352 EDN: AKWOAV
85. Robinson S., Granata L., Hienz R.D., Davis C.M. Temporary inactivation of the medial prefrontal cortex impairs the formation, but not the retrieval of social odor recognition memory in rats // Neurobiol. Learn. Mem. 2019. V. 161. P. 115. DOI: 10.1016/j.nlm.2019.04.003
86. Rochefort C., Gheusi G., Vincent J.D., Lledo P.M. Enriched odor exposure increases the number of newborn neurons in the adult olfactory bulb and improves odor memory // J. Neurosci. 2002. V. 22. № 7. P. 2679. DOI: 10.1523/JNEUROSCI.22-07-02679.2002
87. Rolls E.T., Deco G., Huang C.C., Feng J. The effective connectivity of the human hippocampal memory system // Cereb. Cortex. 2022. V. 32. № 17. P. 3706. DOI: 10.1093/cercor/bhab442 EDN: YFVGPE
88. Roman F.S., Truchet B., Chaillan F.A., Marchetti E., Soumireu-Mourat B. Olfactory associative discrimination: a model for studying modifications of synaptic efficacy in neuronal networks supporting long-term memory // Rev. Neurosci. 2004. V. 15. № 1. P. 1. DOI: 10.1515/revneuro.2004.15.1.1
89. Roullet P., Bourne R., Moricard Y., Stewart M.G., Sara S.J. Learning-induced plasticity of N-methyl-D-aspartate receptors is task and region specific // Neuroscience. 1999. V. 89. № 4. P. 1145. DOI: 10.1016/s0306-4522(98)00404-7 EDN: ACGRVX
90. Russo M.J., Franks K.M., Oghaz R., Axel R., Siegelbaum S.A. Synaptic organization of anterior olfactory nucleus inputs to piriform cortex // J. Neurosci. 2020. V. 40. № 49. P. 9414. DOI: 10.1523/JNEUROSCI.0965-20.2020 EDN: GMIXNW
91. Rusznák Z., Sengul G., Paxinos G., Kim W.S., Fu Y. Odor Enrichment Increases Hippocampal Neuron Numbers in Mouse // Exp. Neurobiol. 2018. V. 27. № 2. P. 94. DOI: 10.5607/en.2018.27.2.94
92. Sahay A., Wilson D.A., Hen R. Pattern separation: a common function for new neurons in hippocampus and olfactory bulb // Neuron. 2011. V. 70. № 4. P. 582. DOI: 10.1016/j.neuron.2011.05.012
93. Saiz-Sanchez D., De La Rosa-Prieto C., Ubeda-Bañon I., Martinez-Marcos A. Interneurons and beta-amyloid in the olfactory bulb, anterior olfactory nucleus and olfactory tubercle in APPxPS1 transgenic mice model of Alzheimer’s disease // Anat. Rec (Hoboken). 2013. V. 296. № 9. P. 1413. DOI: 10.1002/ar.22750
94. Sakamoto M., Ieki N., Miyoshi G. et al. Continuous postnatal neurogenesis contributes to formation of the olfactory bulb neural circuits and flexible olfactory associative learning // J. Neurosci. 2014. V. 34. № 17. P. 5788. DOI: 10.1523/JNEUROSCI.0674-14.2014
95. Schmidt-Hieber C., Jonas P., Bischofberger J. Enhanced synaptic plasticity in newly generated granule cells of the adult hippocampus // Nature. 2004. V. 429. № 6988. P. 184. DOI: 10.1038/nature02553
96. Schwerdtfeger W.K., Buhl E.H., Germroth P. Disynaptic olfactory input to the hippocampus mediated by stellate cells in the entorhinal cortex // J. Comp. Neurol. 1990. V. 292. № 2. P. 163. DOI: 10.1002/cne.902920202
97. Silkis I. A hypothetical role of cortico-basal ganglia-thalamocortical loops in visual processing // Biosystems. 2007. V. 89. № 1–3. P. 227. DOI: 10.1016/j.biosystems.2006.04.020 EDN: KGWSIY
98. Soung A.L., Vanderheiden A., Nordvig A.S. et al. COVID-19 induces CNS cytokine expression and loss of hippocampal neurogenesis // Brain. 2022. V. 145. № 12. P. 4193. DOI: 10.1093/brain/awac270 EDN: RBCXBK
99. Srinivas K.V., Buss E.W., Sun Q. et al. The Dendrites of CA2 and CA1 Pyramidal Neurons Differentially Regulate Information Flow in the Cortico-Hippocampal Circuit // J. Neurosci. 2017. V. 37. № 12. P. 3276. DOI: 10.1523/JNEUROSCI.2219-16.2017
100. Stevenson E.L., Caldwell H.K. Lesions to the CA2 region of the hippocampus impair social memory in mice // Eur. J. Neurosci. 2014. V. 40. № 9. P. 3294. DOI: 10.1111/ejn.12689
101. Strauch C., Hoang T.H., Angenstein F., Manahan-Vaughan D. Olfactory information storage engages subcortical and cortical brain regions that support valence determination // Cereb. Cortex. 2022. V. 32. № 4. P. 689. DOI: 10.1093/cercor/bhab226 EDN: AFZOBV
102. Strauch C., Manahan-Vaughan D. In the piriform cortex, the primary impetus for information encoding through synaptic plasticity is provided by descending rather than ascending olfactory inputs // Cereb. Cortex. 2018. V. № 2. P. 764. DOI: 10.1093/cercor/bhx315 EDN: YEJKCT
103. Syversen I.F., Witter M.P., Kobro-Flatmoen A. et al. Structural connectivity-based segmentation of the human entorhinal cortex // Neuroimage. 2021. V. 245. P. 18723. DOI: 10.1016/j.neuroimage.2021.118723 EDN: MAWCTX
104. Taxidis J., Pnevmatikakis E.A., Dorian C.C. et al. Differential Emergence and Stability of Sensory and Temporal Representations in Context-Specific Hippocampal Sequences // Neuron. 2020. V. 108. № 5. P. 984.e9. DOI: 10.1016/j.neuron.2020.08.028 EDN: IJYJEE
105. Tamamaki N., Nojyo Y. Preservation of topography in the connections between the subiculum, field CA1, and the entorhinal cortex in rats // J. Comp. Neurol. 1995. V. 353. № 3. P. 379. DOI: 10.1002/cne.903530306
106. Traub R.D., Whittington M.A. Processing of cell assemblies in the lateral entorhinal cortex // Rev. Neurosci. 2022. V. 33. № 6. P. 829. DOI: 10.1515/revneuro-2022-0011 EDN: YKFSXG
107. Truchet B., Chaillan F.A., Soumireu-Mourat B., Roman F.S. Early integrative processes physiologically observed in dentate gyrus during an olfactory associative training in rat // J. Integr. Neurosci. 2002. V. 1. № 1. P. 101. DOI: 10.1142/s0219635202000062
108. Truchet B., Chaillan F.A., Soumireu-Mourat B., Roman F.S. Learning and memory of cue-reward association meaning by modifications of synaptic efficacy in dentate gyrus and piriform cortex // Hippocampus. 2002. V. 12. № 5. P. 600. DOI: 10.1002/hipo.10097
109. Uva L., de Curtis M. Polysynaptic olfactory pathway to the ipsi- and contralateral entorhinal cortex mediated via the hippocampus // Neuroscience. 2005. V. 130. № 1. P. 249. DOI: 10.1016/j.neuroscience.2004.08.042
110. Vandenbroucke A.R.E., Fahrenfort J.J., Meuwese J.D.I., Scholte H.S., Lamme V.A.F. Prior Knowledge about Objects Determines Neural Color Representation in Human Visual Cortex // Cereb. Cortex. 2016. V. 26. № 4. P. 1401. DOI: 10.1093/cercor/bhu224
111. Vanderwolf C.H. The hippocampus as an olfacto-motor mechanism: were the classical anatomists right after all? // Behav. Brain Res. 2001. V. 127. № 1–2. P. 25. DOI: 10.1016/s0166-4328(01)00354-0 EDN: AFYWIN
112. van Groen T., Wyss J.M. Extrinsic projections from area CA1 of the rat hippocampus: olfactory, cortical, subcortical, and bilateral hippocampal formation projections // J. Comp. Neurol. 1990. V. 302. № 3. P. 515. DOI: 10.1002/cne.903020308
113. van Rijzingen I.M., Gispen W.H., Spruijt B.M. Olfactory bulbectomy temporarily impairs Morris maze performance: an ACTH (4–9) analog accellerates return of function // Physiol. Behav. 1995. V. 58. P. 147. -E. DOI: 10.1016/0031-9384(95)00032
114. Weeden C.S., Hu N.J., Ho L.U., Kesner R.P. The role of the ventral dentate gyrus in olfactory pattern separation // Hippocampus. 2014. V. 24. № 5. P. 553. DOI: 10.1002/hipo.22248
115. Wilson R.S., Arnold S.E., Schneider J.A., Tang Y., Bennett D.A. The relationship between cerebral Alzheimer’s disease pathology and odour identification in old age // J. Neurol. Neurosurg. Psychiatry. 2007. V. 78. № 1. P. 30. DOI: 10.1136/jnnp.2006.099721
116. Wilson D.A., Stevenson R.J. The fundamental role of memory in olfactory perception // Trends Neurosci. 2003. V. 26. № 5. P. 243. DOI: 10.1016/S0166-2236(03)00076-6 EDN: BGLBKF
117. Wilson D.I., Watanabe S., Milner H., Ainge J.A. Lateral entorhinal cortex is necessary for associative but not nonassociative recognition memory // Hippocampus. 2013. V. 23. № 12. P. 1280. DOI: 10.1002/hipo.22165
118. Woods N.I., Stefanini F., Apodaca-Montano D.L. et al. The Dentate Gyrus Classifies Cortical Representations of Learned Stimuli // Neuron. 2020. V. 107. № 1. P. 173.e6. DOI: 10.1016/j.neuron.2020.04.002 EDN: POJIYZ
119. Xu W., Lopez-Guzman M., Schoen C. et al. Spared piriform cortical single-unit odor processing and odor discrimination in the Tg2576 mouse model of Alzheimer’s disease // PLoS One. 2014. V. 9. № 9. P. e106431. DOI: 10.1371/journal.pone.0106431
120. Xu W., Wilson D.A. Odor-evoked activity in the mouse lateral entorhinal cortex // Neuroscience. 2012. V. 223. P. 12. DOI: 10.1016/j.neuroscience.2012.07.067
121. Yamamoto T. Involvement of the olfactory system in learning and memory: a close correlation between the olfactory deficit and the course of Alzheimer’s disease? // Yakubutsu Seishin Kodo. 1991. V. 11. № 4. P. 223.
122. Yoder W.M., Gaynor L.S., Burke S.N. et al. Interaction between age and perceptual similarity in olfactory discrimination learning in F344 rats: relationships with spatial learning // Neurobiol. Aging. 2017. V. 53. P. 122. DOI: 10.1016/j.neurobiolaging.2017.01.023
123. Zhang S., Manahan-Vaughan D. Spatial olfactory learning contributes to place field formation in the hippocampus // Cereb. Cortex. 2015. V. 25. № 2. P. 423. DOI: 10.1093/cercor/bht239
124. Zheng J.Q. Cortical projections from the reuniens nucleus of the thalamus in the rat // Kaibogaku Zasshi. 1994. V. 69. № 3. P. 261.
125. Zhou G., Olofsson J.K., Koubeissi M.Z. et al. Human hippocampal connectivity is stronger in olfaction than other sensory systems // Prog. Neurobiol. 2021. V. 201. P. 102027. DOI: 10.1016/j.pneurobio.2021.102027 EDN: CVRVTV
Выпуск
Другие статьи выпуска
Заболеваемость сахарным диабетом (СД) во всем мире неуклонно растет, а вместе с этим отмечается рост его осложнений, которые являются главными причинами ранней инвалидизации и преждевременной смерти. В основе патогенеза СД лежит неуклонное уменьшение числа β-клеток поджелудочной железы при СД 1 типа до 30–10%, при СД 2 типа до 50–40% от нормального количества. Уменьшение β-клеточной массы ведет к снижению продукции инсулина и развитию гипергликемии и связанных с ней тяжелых осложнений. Поэтому очевидна необходимость предупреждения гибели β-клеток и стимуляции их регенерации. В зарубежной литературе последнего времени уделяется большое внимание роли ГАМК в регуляции функции α- и β-клеток поджелудочной железы и углеводного обмена, что в отечественной литературе практически не отражено, чему и посвящен данный обзор. Гамма-аминомасляная кислота (ГАМК) в β-клетках и островках поджелудочной железы определяется в количествах, сопоставимых с содержанием в головном мозге. Там же содержится и высокое количество глутамадекарбоксилазы – фермента, синтезирующего ГАМК. При СД уровень ГАМК в β-клетках поджелудочной железы снижается и это коррелирует с тяжестью нарушений углеводного обмена. ГАМК играет важную роль в паракринной регуляции функций α- и β-клеток, углеводного гомеостаза. Доказана потенциальная возможность с помощью ГАМК добиться снижения апоптоза и, одновременно, усиления регенерации β-клеток, увеличения β-клеточной массы поджелудочной железы, повышения секреции инсулина, адекватного контроля уровня глюкозы в организме. Доказано, что положительное влияние ГАМК на структуру и функции β-клеток поджелудочной железы при СД может быть существенно выше при совместном применении с антидиабетическими средствами: агонистами рецептора ГПП-1, ингибиторами ДПП-4, ингибиторами SGLT-2 и другими. Антидиабетические свойства ГАМК объясняются ее взаимодействием с различными сигнальными белками (белком Клото, SIRT, PI3K/Akt, CREB-IRS2, NF-kB, Nrf2 и многими другими), посредством модуляции которых эти эффекты реализуются. Данные о панкреопротективном действии ГАМК и ее производных могут лечь в основу разработки новой фармакотерапевтической стратегии лечения СД и сопряженных с ними осложнений.
Тромбоциты играют ключевую роль в развитии тромбоза и воспаления. Они являются ключевыми участниками патологического тромбоза в силу своей способности прикрепляться к поврежденным участкам кровеносных сосудов и дальнейшему накоплению в местах нарушения. Хотя активацию и адгезию тромбоцитов следует рассматривать как физиологический ответ на внезапную трещину или разрыв атеросклеротической бляшки, что в конечном итоге способствует ее репарации, неконтролируемое прогрессирование такого процесса в коронарных артериях может завершиться образованием окклюзирующего просвет сосуда тромба, приводящего к развитию инфаркта миокарда. Настоящий обзор посвящен, в основном, рассмотрению коррекции функции тромбоцитов с помощью антитромбоцитарных препаратов, которые обусловили существенные позитивные изменения в борьбе с острым коронарным синдромом и инфарктом миокарда.
Воспалительные заболевания кишечника (Inflammatory Bowel Disease, IBD), включая язвенный колит (Ulcerative colitis, UC) и болезнь Крона (Crohn’s disease, CD), представляют собой группу хронических иммуноопосредованных заболеваний желудочно-кишечного тракта со сложной патофизиологией и патогенезом. Хотя точные патофизиологические и молекулярные механизмы, ассоциированные с IBD, изучены недостаточно, в последние годы получены данные об активации и изменении функций ноцицепторов и их сигнальных путей при воспалительном процессе и гипералгезии, в частности одна из ключевых ролей отводится каналу транзиторного рецепторного ванилоидного потенциала 1 (TRPV1). Наибольший уровень экспрессии TRPV1 характерен для сенсорных нейронов, однако он способен экспрессироваться и другими типами клеток, включая эпителиальные клетки кишки и мочевого пузыря, иммунореактивные клетки, такие как лимфоциты, тучные и дендритные клетки, клетки эндотелия сосудов и др. Все большее число исследований на различных экспериментальных моделях, включая человека, демонстрирует, что активация каналов суперсемейства TRP, к которому относится и TRPV1, может существенно усиливать висцеральную гиперчувствительность, опосредовать развитие воспаления и боли. Обзор обобщает представленные в литературе данные, раскрывающие структуру, функции и потенциальную роль в патогенезе IBD канала-рецептора TRPV1. Большое внимание уделено обсуждению сигнальных путей, лежащих в основе модуляции TRPV1. Можно надеяться, что дальнейшие исследования в данной области будут способствовать лучшему пониманию общих механизмов формирования воспалительной и болевой реакции и выявлению новых терапевтических мишеней для лечения IBD.
Кальций является ключевым и универсальным вторичным посредником, эффективным регулятором метаболических процессов. Кальциопатии – нарушения использования кальция в клетке, вызванные дисфункцией субъединиц ионного канала и/или регулирующих их белков, включают отклонения в работе регуляторных путей и митохондрий, сопровождают нейропсихиатрические заболевания. Выявление ассоциированных генов кальциевого обмена и изучение роли изменений в их работе в детерминации подобных состояний важно для поиска новых молекулярных мишеней направленной фармакотерапии расстройств психики и сопутствующих заболеваний, их профилактики. Обзор посвящен рассмотрению физиологических и генетических нарушений в регуляции кальциевого гомеостаза, взаимосвязи с психоневропатологией различного генеза, известным и перспективным терапевтическим подходам к их лечению, основанным на воздействии на процессы кальциевого обмена и активность генов кальциевого ответа.
Обзор посвящен проблеме умеренного гипоксического воздействия как естественного, немедикаментозного стимула, активирующего механизмы формирования гипоксической толерантности мозга. В обзоре освещается история и современный уровень исследований этой проблемы, а также рассматриваются условия нейропротективной эффективности гипоксического кондиционирования в качестве превентивного (прекондиционирование) и корректирующего (посткондиционирование) воздействия. Раскрываются физиологические и молекулярно-клеточные механизмы пре- и посткондиционирования. Особое внимание уделяется собственным исследованиям кондиционирования мозга с использованием умеренной гипобарической гипоксии.
Статистика статьи
Статистика просмотров за 2025 - 2026 год.
Издательство
- Издательство
- ИЗДАТЕЛЬСТВО НАУКА
- Регион
- Россия, Москва
- Почтовый адрес
- 121099 г. Москва, Шубинский пер., 6, стр. 1
- Юр. адрес
- 121099 г. Москва, Шубинский пер., 6, стр. 1
- ФИО
- Николай Николаевич Федосеенков (Директор)
- E-mail адрес
- info@naukapublishers.ru
- Контактный телефон
- +7 (495) 2767735