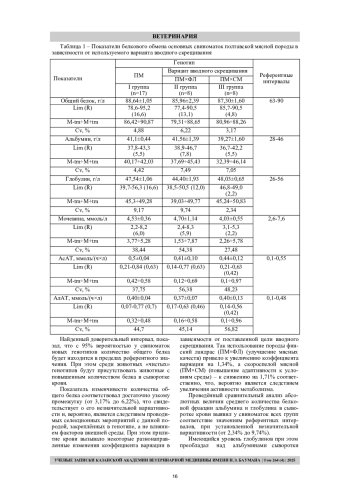
Цель работы - изучение изменчивости показателей белкового обмена в крови основных свиноматок полтавской мясной породы при оценке различных вариантов вводного скрещивания. Исследования были проведены на трёх группах основных свиноматок, различных по генотипу: I группа - чистопородные свиноматки полтавской мясной породы (n=17), II группа - свиноматки, полученные методом вводного скрещивания с использованием 12,5% доли крови финского ландраса (n=8), III группа - свиноматки, полученные методом вводного скрещивания с использованием 12,5% доли крови скороспелой мясной породы (n=8). Показатели белкового обмена у обследуемых свиноматок всех групп, за исключением коэффициента де Ритиса, находились в границах референтных интервалов. Наименьшие значения коэффициента вариации установлены у показателей общего белка, альбумина и глобулина (от 2,34% до 9,74%), наибольшие – у показателей активности АсАТ и АлАТ (от 37,75% до 56,82%). Использование различных вариантов вводного скрещивания у основных свиноматок полтавской мясной породы не приводило к достоверным изменениям в средних значениях показателей белкового обмена. Прилитие крови финского ландраса приводило к увеличению изменчивости показателей белкового обмена (за исключением коэффициента де Ритиса) от 0,44% до 18,63% в сравнении с чистопородными свиноматками. Прилитие крови скороспелой мясной породы приводило к снижению изменчивости показателей общего белка (на 1,71%), глобулина (на 6,83%), мочевины (на 10,96%), А/Г (на 3,33%), соотношения альбумин/мочевина (на 20,88%), соотношения глобулин/мочевина (на 11,43%), коэффициента де Ритиса (на 5,83%) соответственно. Использование породы финский ландрас для улучшения продуктивности приводит к более отличным сдвигам в метаболических потоках обмена белков и требует большего внимания к условиям разведения животных т. к. желаемое улучшение приводит к напряжению защитно-приспособительных и адаптивных качеств свиноматок. Повышение адаптивности свиноматок за счёт резервов скороспелой мясной породы приводит к менее значимым изменениям в белковом обмене и меньшему его напряжению, в сравнении с чистым генотипом.
Идентификаторы и классификаторы
- SCI
- Ветеринария
Основным методом разведения в свиноводстве, при котором спаривают хряков и свиноматок, принадлежащих к разным породам, является скрещивание [1]. Это один из самых быстрых методов для улучшения различных характеристик сельскохозяйственных животных [2]. Скрещивание является неотъемлемым компонентом программы улучшения пород свиней [3], при этом, как правило, различные системы скрещивания на практике используют либо для снижения уровня инбридинга потомства, либо для проявления эффекта гетерозиса, также известного как гибридная энергия [1, 4].
Список литературы
1. Чистопородное разведение и двухпородное скрещивание свиней разного экогенеза в условиях промышленной технологии Западной Сибири / В. Н. Дементьев, А. А. Фридчер, А. И. Желтиков [и др.] // Главный зоотехник. 2024. № 3 (248). С. 19-26. DOI: 10.33920/sel-03-2403-02
2. Efficiency of crossing paternal line males and maternal line females of rabbits on growth performance / G.M. Abd El-Latif, A.M. Abd El-Hady, A. Eldlebshany, A. EL-Raffa // Egyptian Poultry Science Journal. 2021. 41/4. P. 709-722. DOI: 10.21608/epsj.2021.213293
3. Chapter 3 - Breeding management in commercial pig farms / S. Vaishnav, T. Saini, Sh. F. Ahmad [et al.] // Commercial Pig Farming. A Guide for Swine Production and Management. 2025. P. 29-46. DOI: 10.1016/B978-0-443-23769-0.00003-8
4. Persistence of autozygosity in crossbreds between autochthonous and cosmopolitan breeds of swine: a simulation study / M.Ch. Fabbria, E. Lozada-Sotob, F. Tiezzia [et al.] // Animal. 2024. Vol. 18, Issue 2, 10170. DOI: 10.1016/j.animal.2023.101070
5. Гарская Н. А., Перетятько Л. Г. Анализ селекционно-генетических показателей воспроизводительной способности свиноматок полтавской мясной породы с различными вариантами доли кровности скороспелой мясной породы // Генетика и разведение животных. 2020. № 2. С. 10-15. DOI: 10.31043/2410-2733-2020-2-10-15
6. Жучаев К. В., Кочнева М. Л., Борисенко Е. А. Благополучие продуктивных животных (обзор) // Сельскохозяйственная биология. 2024. Т. 59. № 6. С. 1025-1038. DOI: 10.15389/agrobiology.2024.6.1025rus
7. Байтимирова Е. А., Янкина О. Л., Ким Н. А. Адаптационные особенности свиней породы ландрас датской селекции // Свиноводство. 2020. № 5. С. 13-15. DOI: 10.37925/0039-713X-2020-5-13-15
8. Онтогенетические особенности гормонального статуса и метаболического профиля свиней в условиях промышленной технологии / К. В. Жучаев, М. Л. Кочнева, Л. В. Осадчук [и др.] // Онтогенетические особенности гормонального статуса и метаболического профиля свиней в условиях промышленной технологии // Вестник НГАУ (Новосибирский государственный аграрный университет). 2024. № 4 (73). С. 177-187. EDN: RZYUXM. DOI: 10.31677/2072-6724-2024-73-4-177-187
9. Морфологический и биохимический статус крови свиней разного генотипа ирландской селекции в условиях Алтайского края / С. В. Бурцева, А. И. Афанасьева, В. А. Сарычев [и др.] // Вестник Алтайского государственного аграрного университета. 2023. № 5 (223). С. 65-69. DOI: 10.53083/1996-4277-2023-223-5-65-69
10. Влияние сроков откорма на метаболиты крови свиней породы ландрас и их двухпородных гибридов / Н. С. Колесник, О. Н. Сивкина, О. А. Воронина [и др.] // Аграрная наука Евро-Северо-Востока. 2025. Т. 26. № 4. С. 872-884. DOI: 10.30766/2072-9081.2025.26.4.872-884
11. Владимиров Г. И. Референсные интервалы общего белка и его фракций в сыворотке крови гибридных ремонтных свинок: возрастные особенности // Ветеринария и кормление. 2023. № 7. С. 20-24. DOI: 10.30917/ATT-VK-1814-9588-2023-7-5
12. Зеленченкова А. А., Сивкина О. Н., Зайцев С. Ю. Кровь как метод оценки благополучия свиней на откорме // Аграрный вестник Урала. 2025. Т. 25, № 3. С. 422-433. DOI: 10.32417/1997-4868-2025-25-03-422-433
13. The effect of different variants of pig introductory crossing on the variability of blood protein metabolism / N. Garskaya, S. Tresnitskiy, A. Rudenko [et al.] // BIO Web Conf. 2024. V. 138 / International Scientific and Practical Conference “Development and Modern Problems of Aquaculture” (AQUACULTURE 2024). DOI: 10.1051/BIOCONF/202413801021
14. Зайцев С. Ю., Боголюбова Н. В., Молянова Г. В. Биохимический анализ крови ряда пород свиней и их гибридов. Монография. Москва: Издательство “Сельскохозяйственные технологии”, 2022. 256 с. 10.18720/SPBPU/2/z22-20. DOI: 10.18720/SPBPU/2/z22-20.ISBN ISBN: 978-5-6048278-9-5
15. Великодная Е. К., Карпенко Л. Ю. Влияние физических нагрузок на иммунно-биохимический статус спортивных лошадей (Обзор литературы) // Актуальные вопросы ветеринарной биологии. 2025. № 2 (66). С. 3-12. DOI: 10.24412/2074-5036-2025-266-3-12
16. Зайцев С. Ю. Сравнительная оценка физиолого-биохимических показателей крови ряда пород свиней и их гибридов. Монография. Москва: Академия Принт, 2024. 230 с. 10.18720/SPBPU/2/z24-16. DOI: 10.18720/SPBPU/2/z24-16.ISBN ISBN: 978-5-605-24753-1
17. Панькова Е. К. Биохимические показатели сыворотки крови свиней разных генотипов // Известия Оренбургского государственного аграрного университета. 2021. № 3 (89). С. 292-296.
Выпуск
Другие статьи выпуска
Высокоудойный молочный скот особенно подвержен риску развития нарушений обмена веществ и алиментарно-обусловленных заболеваний, поскольку их физиология направлена преимущественно на синтез молока, даже при нехватке питательных веществ. Это обусловлено тем, что многолетний отбор по признаку удоя привёл к формированию лактационной доминанты, при которой организм направляет значительную долю ресурсов на продукцию молока, зачастую в ущерб другим системам. Включение в рацион дрожжевых пробиотиков, обладающих способностью поглощать кислород в рубце, способствует формированию благоприятной анаэробной среды для жизнедеятельности его нормофлоры. Генетические факторы играют немаловажную роль в устойчивом закреплении продуктивных признаков у крупного рогатого скота. Целью исследования являлось изучить взаимосвязь полиморфизма гена KCNB1 (g.78216220G>A) на молочную продуктивность коров голштинской породы при скармливании пробиотической дрожжевой добавки «КЛЮВЕР ПРО» на основе штамма дрожжей Kluyveromyces marxianus. Объектами исследования являлись 120 лактирующих коров, сформированных по 60 голов в группе, в условиях СХПК племенного завода им. Ленина Атнинского района Республики Татарстан. Опытной группе дополнительно скармливали по 20 г на голову в сутки добавки «КЛЮВЕР ПРО» в течение 60 дней. В ходе исследования выявили, что по сравнению с контрольным поголовьем группа коров с генотипом KCNB1 АА, получавшая добавку, выгодно отличалась по показателям удоя в сутки в среднем на 6,94%, выходу молочного белка на 10,73%, сумме количества жира и белка на 11,32%, в том числе отмечено достоверное повышение количества молочного жира на 11,86% (p≤0,05). При том же сравнении поголовье с генотипом KCNB1 GG превосходило контрольное по среднесуточному удою на 5,96%, количеству молочного жира на 9,01%, сумме количества жира и белка на 8,83%, и достоверно превосходило по выходу молочного белка на 8,64% (p≤0,05).
В данном исследовании представлены результаты анализа аллелофонда татарской породы лошадей в сравнении с аллелофондом якутской породой, полученные данные могут быть использованы при дальнейшей селекционной работе. Исследованиями установлено, что местные породы лошадей имеют широкий спектр аллелей по полиморфным белкам крови и высокий уровень генетического разнообразия. В изученных породах лошадей локус трансферрина детерминируется 5 аллелями: F, D, R, H, O, а локус альбумина оказался слабо полиморфным и представлен только двумя аллелями: А и В. В результате генетического анализа лошадей татарской и якутской пород было идентифицировано соответственно 15 генотипов из возможных 15 аллельных комбинаций. Наиболее частотным аллелем в обеих популяциях оказался аллель F, его частота у якутской породы лошадей достоверно превышала частоту татарских лошадей на 0,134 (р<0,05), что указывает о значимой дифференциации по данному локусу. В отличие, аллель O трансферрина был представлен минимально: у татарской породы лошадей составила 0,053, а у якутской – 0,030, что соответствует снижению в 1,77 раз. Данный аллель указывает на статистическую схожесть двух пород по данному полиморфизму. В полиморфных системах крови двух пород уровень полиморфности составил в среднем 2,441 и этот результат считается высоким для местных пород лошадей. Лошади татарской породы характеризуются высокой степенью гетерозиготности, которая в среднем составляет 0,597, что в сравнении с тем же показателем у якутской породы выше на 0,191. Следовательно, у татарской и якутской пород в локусах полиморфных белков крови четко прослеживаются определенные межпородные различия по частотам аллелей, степени гетерозиготности и числу эффективных аллелей, что указывает на определенную генетическую отдаленность изученных пород лошадей
В статье представлены результаты исследования влияния полиморфизма генов соматотропинового каскада (PRL, PIT1, GH) на физико-химические показатели молока коров джерсейской породы, с целью выявления генотипов, ассоциированных с улучшенными качественными характеристиками молока. Аллельные варианты генов PRL, PIT1, GH определены методом полимеразной цепной реакции с последующим определением полиморфизма длин рестрикционных фрагментов (ПЦР-ПДРФ). Результаты исследования демонстрируют, что полиморфизм гена пролактина оказывает наиболее выраженное влияние на качественные показатели молока. В частности, коровы с генотипами PRL AB и BB характеризуются достоверно более высоким содержанием сухого вещества (16,16% и 16,22% против 15,82% у AA), жира (6,27% и 6,24% против 6,07% у AA), белка и лактозы, а также повышенной энергетической ценностью молока (95,1 и 95,2 ккал против 92,7 ккал у AA). Относительно гена гипофизарного фактора транскрипции установлено, что коровы с генотипом PIT1 AB имеют преимущество по содержанию сухого вещества (16,23%), СОМО (10,55%), белка (3,99%) и лактозы (5,20%), в то время как наивысшее содержание жира (6,35%) обнаружено у животных с генотипом PIT1 AA. Животные с генотипом GH LL демонстрируют более высокое содержание сухого вещества (15,46%) и энергетическую ценность молока (95,6 ккал) по сравнению с коровами генотипов GH LV и GH VV. Исследование подтверждает перспективность использования полиморфизма генов соматотропинового каскада в качестве генетических маркеров для селекционной работы, направленной на повышение качественных показателей молока коров джерсейской породы.
ДНК-технологии дают возможность реализовать принципиально новые подходы в селекции животных. Прежде всего это генетическая идентификация конкретных особей с последующим генетико-популяционным анализом, обеспечивающим получение количественных характеристик генофондов исследуемых популяций. Целью исследования было установить физиологические особенности роста и развития поросят разных генотипов по генам FUT1 и MUC4 при добавлении витаминной подкормки. Исследования выполняли с 2023 по 2024 гг. В работе использовали 88 поросят крупной белой породы в период от рождения до отъёма. Животные были разделены на 6 групп. Поросята в каждой группе взвешивались в первый день жизни, на 3 сутки, и затем через каждые 3 суток до возраста 21 день. Наибольшая живая масса была у поросят с генотипом АА/GG (FUT1/MUС4), потом следовали особи с генотипом АG/GС (FUT1/MUС4) кроме третьей группы, и наименьшая живая масса была у поросят с генотипом GG/СС (FUT1/ MUС4). В третьей группе животных максимальная живая масса была более 5860 г у генотипа АА/GG (FUT1/MUС4), что на 352,1 г больше (р<0,05) от генотипа GG/СС (FUT1/MUС4) и на 676,6 г больше (р<0,001) генотипа АG/GС (FUT1/MUС4). В четвертой группе поросят максимальная живая масса была более 5710 г у генотипа АА/GG (FUT1/MUС4), что на 681,53 г больше (р<0,05) от генотипа GG/СС (FUT1/MUС4) и на 153 г больше генотипа АG/GС (FUT1/MUС4). Таким образом, полученные результаты указывают на то, что генотипирование поросят по генам FUT1 и MUС4 может быть использовано не только для определения устойчивости к кишечным инфекциям, но и для прогнозирования физиологических особенностей роста и развития на ранних стадиях онтогенеза.
Исследование посвящено анализу деятельности испытательного центра (ИЦ) государственного бюджетного учреждения «Республиканская ветеринарная лаборатория» Республики Татарстан и его роли в обеспечении биологической безопасности животноводства. Свою деятельность ИЦ осуществляет на основе Положения об ИЦ, в соответствии с требованиями регионального и федерального законодательства, а также международных стандартов. На основе систематического изучения документации, результатов опросов ветеринарных специалистов и статистического анализа установлено, что ИЦ выполняет ключевые функции: аккредитацию лаборатории, методическую поддержку районных ветеринарных лабораторий, контроль качества исследований, расширение областей аккредитации. В структуре ИЦ работают четыре специалиста: руководитель, заместитель руководителя, ветеринарный врач – метролог и ветеринарный врач – менеджер по качеству. Основные направления деятельности ИЦ включают организацию внутрилабораторного контроля, проведение межлабораторных сличительных испытаний, входной контроль реактивов и оборудования, а также подготовку протоколов испытаний. Статистические данные за 2021-2024 годы показывают значительный рост бактериологических (до 147,6%), токсикологических (до 265,8%) и паразитологических (до 406,1%) исследований. Особое внимание уделяется исследованиям особо опасных заболеваний животных – бешенство, бруцеллез, туберкулез, сибирская язва, африканская чума свиней. Установлено, что ИЦ постоянно взаимодействует с заказчиками исследований – крупными агрохолдингами республики и личными подсобными хозяйствами граждан. Такое взаимодействие способствует повышению достоверности проведённых лабораторных исследований. Результаты подтверждают, что деятельность ИЦ на прямую влияет на биологическою безопасность в животноводстве, предотвращая распространение особо опасных болезней животных и тем самым снижая экономические потери в республике. Данное исследование имеет практическую ценность для совершенствования организации работы ветеринарных лабораторий и разработки мер по повышению качества ветеринарного обслуживания.
В работе представлены результаты трансректального ультразвукового исследования и лечения посткоитального эндометрита у кобыл американской рысистой породы. Целью исследования являлось изучение в сравнительном аспекте двух схем лечения посткоитального эндометрита у кобыл американской рысистой породы в условиях ООО «Поворот ВП». Результативность лечения отслеживалась с помощью повторной комплексной репродуктивной оценки, которая включала в себя трансректальное УЗИ, вагиноскопию, мануальное исследование влагалища и исследование гематологических показателей крови. При возникновении посткоитального эндометрита необходимо назначать следующую схему лечения: Лаваж матки раствором натрия хлорида 0,9% 3 л + гентамицина сульфат 4% 4 мл на каждый литр натрия хлорида. После введения в полость матки 3 л раствора вводится гормональный препарат Окситоцин 10МЕ 2,5 мл внутривенно. Далее повторение введения Окситоцина с интервалом 5 ч внутримышечно, комбинированный препарат Гамавит 1 мл на 1 кг раз в 48 часов внутримышечно. Применение схемы лечения с использованием гентамицина сульфата у кобыл опытной группы даёт наилучший результат, поскольку в контрольной группе стали жеребыми 2 кобылы из 3 (66,67%), а в опытной группе 3 кобылы из 3 (100%). Применение предложенной схемы лечения способствовало нормализации гематологических показателей и выздоровлению животных: уменьшение содержания нейтрофилов после лечения говорит о завершении нейтрофильной фазы борьбы с воспалительным процессом, повышение моноцитов является маркером завершения воспалительного процесса и начала периода восстановления организма.
Цель исследований – отобрать высокоиммуногенные штаммы ротавируса свиней. В качестве вируссодержащего материала использованы образцы патоматериала от павших поросят до 10-дневного возраста из неблагополучных по ротавирусной болезни свиней хозяйств Республик Башкортостан и Татарстан. Для выделения возбудителя использовали перевиваемые линии культур клеток РК-15 и SPEV. С этой целью осуществляли слепые пассажи суспензий патологического материала и вышеуказанных культур клеток. За период исследований было проведено 7 пассажей. С целью изучения биологических свойств, полученных изолятов, приведены исследования по оценке одного из важнейших биологических свойств вируса-цитопатического действия на поражаемые им животные клетки. Для этого в качестве биологической модели использовали культуры клеток (PK-15 и SPEV). Установлено, что в 6 из 32 отобранных образцов из тканей легких, селезенки и кишечника регистрировалось цитопатическое действие, которое было более выражено через 48-96 часов в 3 пассаже в виде округления и деструкции клеток, вакуолизации и грануляции цитоплазмы. После 7 пассажа клетки РК-15 и SPEV теряли способность удерживаться на стекле и в поддерживающей среде находились во взвешенном состоянии. Цитопатическое действие было более выражено при выделении вируса из тканей кишечника. Вирусная суспензия была заморожена при температуре – 60℃. Наличие рибонуклеиновой кислоты ротавируса подтверждено в полимеразной цепной реакции с обратной транскрипцией в реальном времени и иммуноферментном анализе.
На базе ООО Научно-производственная фирма «Исследовательский центр», в р. п. Кольцово, НСО и лаборатории кафедры фармакологии и общей патологии факультета ветеринарной медицины Новосибирского ГАУ были проведены научно-практические исследования в области влияния препарата «Ветом-1» и «Ветом-2» на показатели минерального обмена гусей. Изучение биохимических показателей в сыворотке крови гусей проводилась с помощью биохимического анализатора открытого типа iMagic-V7 (версия для ветеринарии), производитель Shenzhen iCubio Biomedical Technology Co., Ltd. Гуси были разделены на 7 опытных групп и 1 контрольную (по 10 голов в каждой группе). Опытные группы принимали препараты с комбикормом в дозах - 50 и 75 мг/кг по разным схемам в течение 15, 30 или 90 суток. После применения препаратов у гусей всех опытных групп были взяты пробы крови на биохимическое исследование. При определении межгрупповых различий пользовались критерием Краскела-Уоллиса, в качестве альтернативного непараметрического аналога критерия Фишера, в рамках однофакторного дисперсионного анализа при сравнении 3-х и более независимых групп. В сыворотке крови определяли кальций, хлориды и сывороточное железо. Препараты не оказали выраженного влияния на уровень кальция (концентрация после применения осталась в пределах физиологической нормы). Уровень хлоридов после применения был снижен, так на 90-е сутки эксперимента в опытных группах № 2, 5, 7 уровень хлоридов снизился на 8,0-10,2% по сравнению с контрольной группой. Концентрация сывороточного железа в опытных группах № 1, 3, 5, 7 снизилась в сравнении с контрольной группой. Наибольший эффект применения препарата отмечался при длительном применении (90-е суток). Препараты в указанных дозах не обладали токсическим эффектом.
В статье представлены результаты исследований по изучению влияния длительного обезвоживания и пищевого хлорида натрия на уровень аргинин-вазотоцина, пролактина, альдостерона и кортикостерона в крови у уток. Исследование проводили на птицах двух групп: контрольной (низкосолевой рацион + вода) и опытной (высокосолевой рацион + 0,5% раствор хлорида натрия). После девяти суток адаптации к рациону были установлены достоверные различия между группами по осмоляльности плазмы, концентрациям натрия и хлора, которые соответствовали уровню потребления хлорида натрия. Длительное обезвоживание вызвало прогрессирующее увеличение осмоляльности плазмы и концентраций натрия и хлора во всех группах, причем у птиц опытной группы эти показатели были достоверно выше. Концентрация калия оставалась относительно стабильной в группе с высоким потреблением натрия в период дегидратации. Исследование выявило значительное повышение уровня аргинин-вазотоцина, который демонстрировал прямую зависимость от уровня потребления хлорида натрия и сильную положительную корреляцию с осмоляльностью плазмы (r=0,958-0,987). Однако при обезвоживании секреция аргинин-вазотоцина достигала плато, несмотря на продолжающийся рост осмоляльности. Уровень пролактина достоверно повышался, демонстрируя тесную корреляцию с осмоляльностью плазмы (r=0,911-0,995) и концентрацией аргинин-вазотоцина (r=0,932-0,957). В отличие от этих гормонов, концентрация альдостерона значительно снижалась на фоне высокого потребления хлорида натрия и демонстрировала слабую отрицательную корреляцию с осмоляльностью и электролитами. Концентрация кортикостерона закономерно увеличивалась в ответ на дегидратацию. Полученные данные свидетельствуют о комплексных изменениях в осморегуляции и гормональном статусе уток при длительном обезвоживании и различном уровне потребления хлорида натрия.
Цирковирусные инфекции свиней (ЦВИС), вызываемые преимущественно цирковирусом свиней 2-го типа (ЦВС-2), представляют собой одну из наиболее значимых проблем в мировом свиноводстве. Ключевым инструментом контроля и профилактики ЦВИС является вакцинация. Рекомбинантные аналоги капсидного белка (rCap) цирковируса свиней 2-го типа (ЦВС-2) являются ключевыми компонентами современных диагностических тест-систем и субъединичных вакцин. Стабильность его антигенной активности - критический параметр, определяющий эффективность и воспроизводимость функционального продукта. Целью настоящего исследования явилась разработка и апробация иммуноферментной тест-системы для межоперационного контроля специфической активности белка rCap. Для получения рекомбинантных аналогов капсидного белка ЦВС-2 использовали ранее сконструированные рекомбинантный штамм-продуцент E. coli BL21(DE3)pLysS-ORF2 (для прокариотического аналога) и стабильно экспрессирующую клеточную линию яичников китайского хомячка CHO-K1/PCV-ORF2 (для эукариотического аналога), очистку белков проводили по ранее разработанным протоколам. Для сенсибилизации твердой фазы (полистироловых планшетов) использовали хроматографически очищенный IgG, выделенный из пула сывороток серопозитивных к ЦВС-2 свиней; специфический пероксидазный конъюгат получали перйодатным методом. В результате исследований получен стабильный пероксидазный конъюгат с плотностью мечения 1,5:1. Разработанная тест-система позволила провести полуколичественный анализ рекомбинантного сырья, демонстрируя хорошую воспроизводимость (коэффициент вариации<7%). Установлено, что тест-система является универсальной и позволяет оценивать активность вариантов rCap, полученных как в прокариотических, так и в эукариотических системах экспрессии, корректно распознавая их антигенные детерминанты. Таким образом, внедрение метода полуколичественного ИФА в производственный цикл позволит стандартизировать процесс межоперационного контроля качества биомассы, полученной при помощи технологий рекомбинантных ДНК, и гарантировать стабильные антигенные характеристики вакцинных и диагностических препаратов.
Высокая интенсивность метаболизма цыплят-бройлеров в ранний постнатальный период требует значительного внимания со стороны птицеводов. В этот период происходит формирование физиологических функций на фоне значительных нагрузок. Кроме того, высокие риски инфекционной заболеваемости могут привести к значительным экономическим потерям в птицеводстве. В современном бройлерном птицеводстве широкое применение нашел энрофлоксацин, который используется на ранних этапах онтогенеза птицы. Использование пробиотических препаратов на основе бацилл представляет особый интерес благодаря их способности оптимизировать микробиоценоз и стимулировать естественные механизмы защиты. Целью настоящего исследования явилась сравнительная оценка динамики биохимических показателей крови цыплят-бройлеров при применении антибиотика энрофлоксацина, пробиотического штамма Bacillus subtilis BKM B-3728D (KE) и их комбинации. Эксперимент проводился на 100 цыплятахбройлерах кросса «Росс-308», разделенных на 4 группы: контроль и опытные, получавшие пробиотик, антибиотик энрофлоксацин и их комбинацию. В динамике исследования оценивались биохимические показатели крови и рост животных с статистической обработкой данных критерием Манна-Уитни. Установлено, что применение пробиотика способствовало оптимизации метаболических процессов, проявлявшейся в достоверном снижении уровня глюкозы на 9-15% и активации белкового обмена. В отличие от этого, антибиотикотерапия вызывала функциональное напряжение печени (снижение билирубина на 32% и АЛТ на 35%) и выраженное нарушение липидного обмена (повышение триглицеридов на 104%). Комбинированное применение препаратов не показало синергического эффекта и сопровождалось признаками метаболического стресса. Полученные результаты подтверждают перспективность использования штамма Bacillus subtilis BKM B-3728D для оптимизации метаболического статуса бройлеров, однако полная замена антибиотиков пробиотиками требует дополнительных исследований по подбору совместимых штаммов и разработке эффективных схем применения.
Проведено исследование биохимических показателей крови крупного рогатого скота для определения пороговых значений нормы и патологии при смещении сычуга. Методология включает оценку метаболических процессов и иммунного статуса животных с целью совершенствования системы мониторинга здоровья молочного скота и профилактики нарушений обмена веществ. Цель исследования заключалась в разработке и валидации методики биохимической диагностики дистопии сычуга и метаболических нарушений у лактирующих коров с применением современного аналитического оборудования. Проведено исследование биохимических показателей крови новотельных коров голштинской породы 1-2 лактации. В контрольной группе определены бета-гидроксимасляная кислота 0,25±0,52 г/моль, лактат 1,8±0,71 ммоль/л, инсулин 7,9±1,20 пмоль/л, мочевина 3,15±1,58 пмоль/л. При левом смещении сычуга повышенные значения: бета-гидроксимасляная кислота 1,8±0,36 г/моль, лактат 2,45±0,49 ммоль/л, инсулин 12,15±0,83 пмоль/л, мочевина 8,1±1,09 пмоль/л. При правом смещении сычуга выявлены критические отклонения: снижение бета-гидроксимасляной кислоты до 0,15±0,60 г/моль, максимальный уровень лактата 4,25±0,82 ммоль/л, гипергликемия 125,5±23,12 мг/дл, повышение гамма-глутамилтрансферазы до 86,4±16,64 ед/л, АСТ 163±29,28 ед/л. Показано повышение уровня НЭЖК во всех экспериментальных группах, увеличение гамма-глутамилтрансферазы гипергликемия при правом смешении, повышение АСТ во всех группах относительно контроля. При оценке минерального обмена установлены показатели: кальций 10,1 мг% (8,45-12,42 мг%), фосфор 8,1 мг% (4,9-11,95 мг%), креатинин 97,5 мкмоль/л (35,4-145,2 мкмоль/л), холестерин 158,7 мг% (95,3-198,3 мг%). Выявлены ключевые биохимические маркеры крови новотельных коров (гамма-глутамилтрансфераза, аспартатаминотрансфераза, аланинаминотрансфераза, бета-гидроксимасляная кислота, лактат, мочевина, инсулин, глюкоза, липопротеины низкой плотности), позволяющие на ранних стадиях диагностировать смещение сычуга и метаболические нарушения. Измеренные пороговые значения показателей как для здоровых, так и для животных со смещением, дают возможность оценивать отклонения от нормы. Дополнительно измерение мочевины в крови и молоке может служить индикатором сопутствующего заболеванию нарушения питания.
Наночастицы находят все большее применение в качестве, как компонентов, так и основных действующих веществ лекарственных средств и кормовых добавок, а особое место занимают наночастицы элементов, которые необходимы для жизнедеятельности живых организмов. Селен — это незаменимый микроэлемент, который участвует в различных процессах живых организмов, что подтверждается, как широким спектром гормонов и ферментов в состав которых он входит, так и научных статей, подтверждающих широкий спектр биологической активности и возможностей применения в повседневной ветеринарной практике. Однако в мире в большинстве используют соли селенистой и селеновой кислоты, в частности селенит натрия, который обладает высокой токсичностью, осложняет его использование и не позволяет часто в полной мере быстро восполнить дефицит данного микроэлемента, что в условиях высокой интенсификации промышленного животноводства повышает издержки и, как следствие, себестоимость. В данной работе рассмотрен новый метод синтеза наночастиц с использованием в качестве поставщика селена дихлордиацетофенонилселенида и в качестве стабилизирующего компонента ТВИН-80, который позволил получать наночастицы селена с низкой себестоимостью размером 3-16 нм, что позволяет предполагать высокую усвояемость данных частиц, а растворимость в воде и высокие показатели дзета потенциала позволяют создавать стабильные коллоидные растворы, которые наиболее удобно применять, как перорально при выпаивании, так и инъекционно. Для впервые синтезированных наночастиц были проведены исследования по определению острой токсичности и местно-раздражающего действия, что позволяет вместе с анализом литературных данных говорить о высокой актуальности дальнейших исследований в области применения их в качестве одного или единственного действующего вещества в ветеринарных препаратах и/или кормовых добавках для животных и птиц.
Современный технологический прогресс требует новых решений для стабилизации здоровья человека и животных, в связи с все большим техногенным воздействием на окружающую среду. Каждый год нарастает производство металлов в мире, что приводит к непрерывному загрязнению окружающей среды. Особо стоит отметить негативное влияние тяжелых металлов, которые оказывают пролонгированное и негативное воздействие на живые организмы. Одним из возможных направлений использования наночастиц селена является возможность их использования для снятия отравления тяжелыми металлами, а учитывая, что в литературе есть данные о возможности применения селеноорганических соединений в данных целях, причем в малых дозах, что свидетельствует не о прямом комплекс образовании с тяжелыми металлами, а о активизации иммунной и антиоксидантной системы организма и, как следствие, предотвращении негативного воздействия токсикантов. Нами разработан новый метод синтеза наночастиц селена. Разработанная методика синтеза позволяет синтезировать наночастицы близкого друг другу размера, что положительно должно сказаться на их биологической активности. Синтез наночастиц селена осуществлялся из дихлордиацетофенонилселенида под воздействием аммиака при стабилизации наночастиц ТВИН-80. Было установлено, что наночастицы селена способны снижать степень тяжести отравления солями тяжелых металлов на примере хлорида меди, нитрата ртути и сульфата кадмия при пероральном применении на белых мышах линии BALB/c в дозе 1 мг/кг при LD50=200 мг/кг, что представляет возможность использования данных наночастиц для предотвращения токсических воздействий на организм тяжелых металлов.
Реферат. Биопленки представляют собой организованные сообщества микроорганизмов. Существование в такой форме опосредует их повышенную устойчивость к антибиотикам, дезинфектантам, иммунной системе. Стандартный метод количественной оценки способности бактерий продуцировать биопленку, включающий определение оптической плотности биомассы в микротитровальном планшете, основан на окрашивании биопленки кристаллическим фиолетовым. Использование данного красителя имеет ряд ограничений, среди которых вариабельность экстракции и требования к технике безопасности. Цель исследования – модифицировать методику оценки биопленкообразующей способности микроорганизмов путем применения сафранина в качестве альтернативного индикаторного красителя и провести сравнительный анализ результатов с классическим методом. Исследование выполнено на клинических изолятах Escherichia coli (n=5) и Staphylococcus aureus (n=5), а также эталонных контрольных штаммах. Определение способности культур к биопленкообразованию проводили количественным методом определения этого показателя в микротитровальных планшетах. В рамках методики осуществляли параллельное сравнение получаемых показателей с использованием сафранина и классическим методом окрашивания кристаллическим фиолетовым, для этого каждый эксперимент выполняли в парных независимых планшетах. Окрашивание сафранином обеспечивало систематически более высокие значения оптической плотности (средний прирост составил 0,09; 10,2%), что было статистически значимо (t=5,16; p=0,00059). Между методами выявлена высокая положительная корреляция (r=0,96; p<0,001). В 90% случаев классификация степени адгезии оставалась согласованной, при этом сафранин продемонстрировал лучшую воспроизводимость для большинства штаммов. Полученные результаты подтверждают перспективность сафранина как альтернативного красителя для количественной оценки биопленок. Модифицированный метод может быть внедрен в рутинные лабораторные исследования после валидации и стандартизации, а также использоваться в скрининге антимикробных и антибиопленочных препаратов.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- КГАУ
- Регион
- Россия, Казань
- Почтовый адрес
- 420015, РТ, г. Казань, ул. К. Маркса, д.65
- Юр. адрес
- 420015, РТ, г. Казань, ул. К. Маркса, д.65
- ФИО
- Валиев Айрат Расимович (Ректор)
- E-mail адрес
- rector@kazgau.com
- Контактный телефон
- +7 (843) 5674500
- Сайт
- https://kazgau.ru