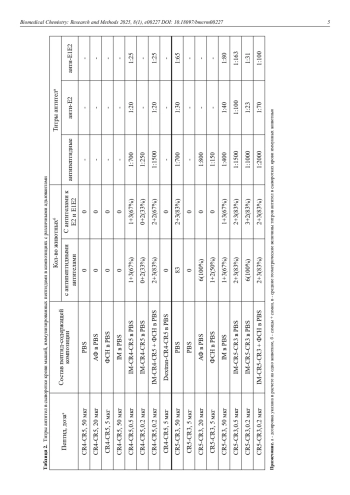
Показано, что эффективность иммунного ответа в виде продукции специфичных антител против иммуногенных пептидных конструкций, составленных из консервативных фрагментов оболочечного белка Е2 вируса гепатита С, зависит от использованных в составе препаратов адъювантов и носителей. Наиболее эффективное образование специфичных антител отмечено в ответ на введение пептидных конструкций, содержащих В- и Т-эпитопы белка Е2, конъюгированных с носителем с адъювантными свойствами Иммуномаксом. Антитела, полученные в ответ на иммунизацию конъюгатами пептидных конструкций с Иммуномаксом, связывали оболочечный белок Е2 и гетеродимер оболочечных белков Е1Е2 вируса гепатита С.
Идентификаторы и классификаторы
Низкая эффективность иммунных ответов на пептидные вакцины, которые пытались внедрять в клиническую практику (например, на терапевтическую вакцину против гепатита С [1, 2] и против SARS-CoV2 («ЭпиВакКорона» [3-5]), не охладила интерес к подобным вакцинам. Это вызвано ранее отмеченными в обзорах преимуществами пептидных вакцин по сравнению с вакцинами на основе цельных микроорганизмов (живых и убитых), субъединичными вакцинами и вакцинами на основе рекомбинантных белков-антигенов: а) безопасные технологии производства пептидов; б) высокая степень стандартизации пептидных антигенов и отсутствие чужеродного генетического материала; в) возможность формирования эффективного иммунного ответа на антигенные детерминанты, обладающие в составе целой молекулы слабой иммуногенностью; г) исключение компонентов и фрагментов молекул патогена, вызывающих высокую реактогенность, аллергические и аутоиммунные реакции; д) возможность компоновки искусственных конструкций из нескольких различных антигенных детерминант, происходящих из разных молекул антигенов [6-9]. Однако одним из основных недостатков пептидных вакцин является их неспособность стимулировать систему врожденного иммунитета и тем самым вызывать формирование достаточно длительного иммунного ответа и иммунологической памяти [6-10]. Пептиды в составе вакцины выполняют функцию иммуногенов – молекул, на которые будет направлен специфический иммунный ответ – образование антител, специфичных к возбудителю заболевания или его основному патогену, стимулирование цитотоксических и хелперных Т-клеток [1, 3, 6-9, 11]. Но для эффективного формирования иммунологической памяти необходимо стимулирование системы врожденного иммунитета и обеспечение достаточно длительного воздействия иммуногена на клетки иммунной системы в зародышевых центрах лимфоузлов [6, 8, 9]. Пептиды, как правило, не могут этого обеспечить из-за отсутствия соответствующей лигандной активности и неустойчивости к действию протеаз биологических жидкостей. Поэтому безусловной необходимостью для пептидных вакцин является подбор адъювантов и носителей, обеспечивающих как активацию системы врожденного иммунитета, так и повышение стабильности пептидных антигенов [8-10]. В настоящей работе было проведено сравнение эффективности иммунного ответа в виде образования специфичных антител на пептидные антигены, составленные из высококонсервативных фрагментов оболочечного белка Е2 вируса гепатита С (ВГС), в сочетании с адъювантами и носителями разного типа.
Список литературы
1. Klade, C.S., Wedemeyer, H., Berg, T., Hinrichsen, H., Cholewinska, G., Zeuzem, S., Blum, H., Buschle, M., Jelovcan, S., Buerger, V., Tauber, E., Frisch, J., Manns, M.P.(2008) Therapeutic Vaccination of Chronic Hepatitis C Nonresponder Patients with the Peptide Vaccine IC41. Gastroenterology, 134(5), 1385-1395. DOI: 10.1053/j.gastro.2008.02.058
2. Firbas, C., Boehm, T., Buerger, V., Schuller, E., Sabarth, N., Jilma, B., Klade, C.S. (2010) Immunogenicity and safety of different injection routes and schedules of IC41, a Hepatitis C virus (HCV) peptide vaccine. Vaccine, 28(12), 2397-407. DOI: 10.1016/j.vaccine.2009.12.072 - P.2397-2407
3. Ryzhikov, A.B., Ryzhikov, E.A., Bogryantseva, M.P., Danilenko, E.D., Imatdinov, I.R., Nechaeva, E.A., Pyankov, O.V. et all. (2021) Immunogenicity and Protectivity of the Peptide Vaccine against SARS-CoV-2. Annals of the Russian Academy of Medical Sciences, 76(1), 5–19. DOI: 10.15690/vramn1572
4. Barchuk, A., Bulina, A., Cherkashin, M., Berezina, N., Rakova,, T., Kuplevatskaya, D., Skougarevskiy, D., Okhotin, A. (2022) Gam-COVID-Vac, EpiVacCorona, and CoviVac effectiveness against lung injury during Delta andOmicron variant surges in St. Petersburg, Russia: a test-negative case-control study. Respiratory Research, 23(1), 276. DOI: 10.1186/s12931-022-02206-3
5. Matveeva, O, Ershov, A. (2022) Retrospective Cohort Study of the Effectiveness of the Sputnik V and EpiVacCorona Vaccines against the SARSCoV- 2 Delta Variant in Moscow (June-July 2021). Vaccines (Basel), 10(7), 984. DOI: 10.3390/vaccines10070984
6. Moysa, A.A., Kolesanova, E.F. (2011) Synthetic peptide vaccines. Biomeditsinskaya Khimiya, 57 (1), 14-30. DOI: 10.18097/PBMC20115701014
7. Chandpa, H.H., Panda, A.K., Meena, C.L., Meena, J. (2023) Beyond the polysaccharide and glycoconjugate vaccines for Streptococcus pneumoniae: Does protein/peptide nanovaccines hold promises? Vaccine, 41(50), 7515-7524. DOI: 10.1016/j.vaccine.2023.11.020
8. Koirala, P., Shalash, A.O., Chen, S.R., Faruck, M.O., Wang, J., Hussein, W.M., Khalil, Z.G., Capon, R.J., Monteiro, M.J., Toth, I., Skwarczynski, M. (2024) Polymeric Nanoparticles as Oral and Intranasal Peptide Vaccine Delivery Systems: The Role of Shape and Conjugation. Vaccines (Basel), 12(2), 198. DOI: 10.3390/vaccines12020198
9. Román-Cruz, V.C., Miller, S.M., Schoener, R.A., Lukasiewicz, C., Schmidt, A.K., DeBuysscher, B.L., Burkhart, D., Seco, P.R., Evans, J.T. (2024) Adjuvanted Vaccine Induces Functional Antibodies against Pseudomonas aeruginosa Filamentous Bacteriophages. Vaccines (Basel), 12(2), 115. DOI: 10.3390/vaccines12020115
10. Huang, Z., Gong, H., Sun, Q., Yang, J., Yan, X.. (2024) Research progress on emulsion vaccine adjuvants. Heliyon. 10(3), e24662. DOI: 10.1016/j.heliyon.2024.e24662
11. . Aleshina, E.Y., Pyndyk, N.V., Moisa, A.A., Sanzhakov, M.A., Kharybin, O.N., Nikolaev, E.N., Kolesanova, E.F. (2008) Synthesis of b-amyloid fragment
5 RHDSGY10 and its isomers with the use of new solid-phase peptide synthesis schedule. Biomeditsinskaya Khimiya, 54(2). 184-191.
12. Kolesanova, E.F., Farafonova, T.E., Aleshina, E.Y., Pyndyk, N.V., Veremieva, M.V., Novosylna, A.V., Kovalenko, M.I., Shalak, V.F, Negrutskii, B.S. (2014) Preparation of monospecific antibodies against isoform 2 of translation elongation factor 1A (eEF1A2). Biomeditsinskaya Khimiya, 60(1), 51-62. DOI: 10.18097/PBMC20146001051
13. Belyavtsev, A.N., Shastina, N.S., Kupriyanov, V.V., Nikolaeva, L.I., Mel’nikova, M.V., Kolesanova, E.F., Shimchishina, M.Y., Kapustin, I.V. (2022) The influence of lipid components on the immunogenicity of synthetic fragment of the virus hepatitis C antigen NS4A. Bioorganicheskaya Khimiya, 48, 453- 460 DOI: 10.31857/S0132342322030046
14. Hou, S.J., Saksena, R., Kovác, P. (2008) Preparation of glycoconjugates by dialkyl squarate chemistry revisited. Carbohydrate Research, 343(2), 196-210. DOI: 10.1016/j.carres.2007.10.015
15. Kuzmina, T.I., Olenina, L.V., Sanzhakov, M.A., Farafonova, T.E., Abramihina, T.V., Dubuisson, J., Sobolev, B.N., Kolesanova, E.F. (2009) Antigenicity and B-epitope mapping of hepatitis C virus envelope protein E2. Biomeditsinskaya Khimiya, 55(1), 32-40.
16. Olenina, L.V., Nikolaeva, L.I., Sobolev, B.N., Blokhina, N.P., Archakov, A.I., Kolesanova, E.F. (2002) Mapping and characterization of B cell linear epitopes in the conservative regions of hepatitis C virus envelope glycoproteins. Journal of Viral Hepatitis, 9(3), 174-182. DOI: 10.1046/j.1365-2893.2002.00358.x
17. Schuler, M.M., Nastke, M.-D., Stevanović, S.. (2007) SYFPEITHI: database for searching and T-cell epitope prediction. Methods in Molecular Biology, 409, 75-93. DOI: 10.1007/978-1-60327-118-9_5
18. Vita, R.R., Overton, J.A., Greenbaum, J.A., Ponomarenko, J , Clark, J.D., Cantrel, J.R., Wheeler, D.K., Gabbard, J.L., Hix, D., Sette, A., Peters, B. (2015) The immune epitope database (IEDB) 3.0. Nucleic Acids Reseach, 43(Database issue), D405–D412. DOI: 10.1093/nar/gku938
19. Kolesanova, E.F., Sobolev, B.N., Moisa, A.A., Egorova, E.A., Archako,v A.I. (2015) The way to the peptide vaccine against hepatitis C. Biomeditsinskaya Khimiya, 61(2), 254-264]. DOI: 10.18097/PBMC20156102254
20. Sobolev, B N., Poroikov, V.V., Olenina, L.V., Kolesanova, E.F., Archakov, A.I. (2000) Comparative analysis of amino acid sequences from envelope proteins isolated from different hepatitis C virus variants: possible role of conservative and variable. . Journal of Viral Hepatitis, 7(5), 368-374. DOI: 10.1046/j.1365-2893.2000.00242.x4
21. Olenina, L.V., Kuzmina, T.I., Sobolev, B.N., Kuraeva, T.E., Kolesanova, E.F., Archakov A.I. (2005) Identification of glycosaminoglycan-binding sites within hepatitis C virus envelope glycoprotein E2. Journal of Viral Hepatitis, 12(6), 584-593. DOI: 10.1111/j.1365-2893.2005.00647.x
22. Zeisel, M.B., Felmlee, D.J., Baumert, T.F. (2013) Hepatitis C virus entry. Curr. Topics Microbiol.Immunol., 369, 87-112. DOI: 10.1007/978-3-642-27340-7_4
23. Farafonova, T.E., Olenina, L.V., Kolesanova ,E.F. Putative hepatitis C virus cell receptors. Biomeditsinskaya Khimiya, 54(2), 154-166.1.
24. Semmo, N., Klenerman, P. (2007) CD4+ T cell responses in hepatitis C virus infection. World J. Gastroenterol., 13(36), 4831-4838. DOI: 10.3748/wjg.v13.i36.4831
25. Margaroni, M., Tsanaktsidou, E., Agallou, M., Kiparissides, C., Kammona, O., Karagouni, E. (2024) Development of a novel squalene/α-tocopherol-based self-emulsified nanoemulsion incorporating Leishmania peptides for induction of antigen-specific immune responses. International Journal of Pharmacology, 649,123621. DOI: 10.1016/j.ijpharm.2023.123621
26. Fox, C.B., Baldwin, S.L., Duthie, M.S., Reed, S.G., Vedvick, T.S.. (2012) Immunomodulatory and physical effects of phospholipid composition in vaccine adjuvant emulsions. AAPS PharmSciTech, 13(2), 498-506. DOI: 10.1208/s12249-012-9771-x
27. Ataullakhanov, R.I., Pichugin, A.V., Mel’nikova, T.M., Khaitov, R.M. (2015) A method for producing a substance with antimicrobial, antiviral and immunostimulating activity, in particular, against dendritic cells, a substance obtained by this method, and a pharmaceutical composition based on it. Russian State Patent Agency Certificate, No.2 563 818 of 21.11.2013.
28. Nikonova, A.A., Pichugin, A.V., Chulkina, M.M., Lebedeva, E.S., Gaisina, A.R., Shilovskiy, I.P., Ataullakhanov, R.I., Khaitov, M.R., Khaitov, R.M. (2018) The TLR4 agonist Immunomax affects the phenotype of mouse lung macrophages during respiratory syncytial virus infection. Acta Naturae, 10(4), 95-99]
29. Masalova, O.V., Lesnova, E.I., Pichugin, A.V., Mel’nikova, T.M., Ulanov, T.I., Burkov, A.N., Ataullakhanov, R.I., Kushch ,A.A. (2008) Issledovanie immunogennosti kovalentnyh konyugatov nestrukturnyh belkov virusa gepatita C s Immunomaksom. Immunologiya, 29, 338-345.
30. Hernandez, A., Patil, N.K., Stother, C.L., Luan, L., McBride, M.A., Owen, A.M., Burelbach, K.R., Williams, D.L., Sherwood, E.R., Bohannon, J.K. (2019) Immunobiology and application of toll-like receptor 4 agonists to augment host resistance to infection. Pharmacological Research, 150, 104502. DOI: 10.1016/j.phrs.2019.104502
Выпуск
Другие статьи выпуска
Определение аминокислотного состава биологических жидкостей имеет важное диагностическое значение. К общепринятым методам анализа аминокислот относятся хроматографические, электрофоретические и масс-спектрометрические методы. Однако в исследовательских целях для решения частных задач зачастую возникает необходимость определения не полного аминокислотного профиля, а концентрации отдельных аминокислот. В настоящем обзоре представлен анализ литературных данных по методам определения индивидуальных аминокислот в биологических жидкостях. Показано, что определение аминокислот можно проводить спектрофотометрическими, электрохимическими методами, а также с использованием широкого набора биосенсоров, при этом предел обнаружения не уступает хроматографическим методам анализа.
DUSP9/MKP-4 принадлежит к семейству биспецифических протеинфосфатаз, негативно регулирующих MAP-киназы (ERK, p38 и JNK). Экспрессия DUSP9 значительно (20-80-кратно) снижена по сравнению c нормальной тканью в 95% исследованных образцов почечно-клеточной карциномы человека. Эти и другие научные данные указывают на то, что DUSP9 является привлекательной мишенью для использования в клинической практике. Однако до сих пор единственным источником клинического материала для исследования экспрессии DUSP9 служили постоперационные биопсийные образцы опухоли. Это значительно ограничивает возможности использования DUSP9 в клинических целях. Целью настоящей работы была оценка возможности обнаружения DUSP9 в моче человека. В работе использовали клетки карциномы почки человека ACHN, трансфицированные DUSP9-экспрессирующим вектором, и образцы мочи 3 здоровых добровольцев. DUSP9 белок детектировали, используя метод Вестерн-блота в лизатах осадков, полученных методом центрифугирования. Мы показали, что белок DUSP9 содержится в осадке фракции мочи, полученной при низкоскоростном центрифугировании (10000 g). Также он присутствует во фракции внеклеточных везикул, обогащенных экзосомами. Полученный результат свидетельствует о том, что анализ экспрессии DUSP9 возможен с помощью жидкостной биопсии. Это может существенно расширить применимость этого анализа в клинических целях.
Выявлена высокая цитотоксическая активность (Z)-(2-(2-Гидрокси-5-хлорфенил)-2-фенилэтенил)алкилдифенилфосфоний хлоридов на уровне препарата сравнения доксорубицина. Протестированные фосфониевые соли в большинстве случаев оказались менее токсичными в отношении условно-нормальных клеточных линий. На примере соединения РР8, содержащего октильный радикал при атоме фосфора, показана частичная остановка клеточного цикла в фазе G1, усиленная генерация активных форм кислорода, а также индукция митохондриального апоптоза опухолевых клеток M-HeLa. Экспериментальные данные подтверждаются повышенным уровнем белков р53, р21, H2A. X и каспазы-9, обнаруженным с помощью мультиплексного анализа, и свидетельствуют о возникновении двухцепочечных разрывов ДНК в результате воздействия исследованного соединения. Таким образом, дальнейшие структурные модификации с целью повышения селективности исследуемых соединений позволят рассматривать их в качестве платформы для создания новых эффективных химиотерапевтических агентов.
Целью исследования было изучение адъювантных свойств хитозана в сравнении с гидроксидом алюминия при иммунизации рекомбинантными белками Pseudomonas aeruginosa. В работе использовали рекомбинантный белок F наружной мембраны (OprF) и рекомбинантный анатоксин P. aeruginosa, к которым добавляли 0.5% препарат хитозана, растворенный в глутаминовой кислоте с pH 5.0 или гель гидроксида алюминия. Испытали соотношение гидроксида алюминия к белку 3:1 и 1:1, а хитозан добавляли в количестве 100 мкг и 50 мкг для одной иммунизирующей дозы. При иммунизации препараты вводили мышам внутрибрюшинно двукратно с двухнедельным интервалом, а затем через две недели животных заражали внутрибрюшинно P. aeruginosa (РА-103), подсчитывая погибших и выживших животных. Иммунизация рекомбинантным белком OprF в дозе 25 мкг и рекомбинантным анатоксином в дозе 50 мкг как с гидроксидом алюминия, так и с хитозаном, способствовала развитию равнозначных протективных свойств. При комплексном введении двух рекомбинантных белков было выявлено усиление защитных свойств с использованием обоих адъювантов. Исследовали возможность применения рекомбинантных антигенов без адъюванта и уменьшения их иммунизирующей дозы при бустерной иммунизации. Снижение иммунизирующей дозы в два раза при повторном введении не уменьшило протективный эффект, а в случае хитозана, приводило к усилению иммунного ответа при бустерной иммунизации рекомбинантными антигенами без адъюванта. Таким образом, для рекомбинантных белков P. aeruginosa выявлены адъювантные свойства хитозана, не уступающие по индукции протективных свойств гидроксиду алюминия.
Статистика статьи
Статистика просмотров за 2025 - 2026 год.
Издательство
- Издательство
- ИБМХ
- Регион
- Россия, Москва
- Почтовый адрес
- 119121, Россия, г. Москва, ул. Погодинская, д. 10, стр.8
- Юр. адрес
- 119121, Россия, г. Москва, ул. Погодинская, д. 10, стр.8
- ФИО
- Пономаренко Елена Александровна (Директор)
- E-mail адрес
- dir@ibmc.msk.ru
- Контактный телефон
- +7 (499) 2466980