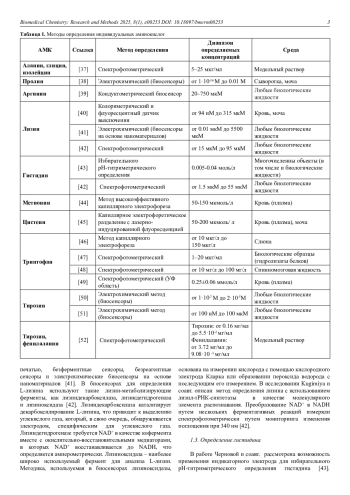
Определение аминокислотного состава биологических жидкостей имеет важное диагностическое значение. К общепринятым методам анализа аминокислот относятся хроматографические, электрофоретические и масс-спектрометрические методы. Однако в исследовательских целях для решения частных задач зачастую возникает необходимость определения не полного аминокислотного профиля, а концентрации отдельных аминокислот. В настоящем обзоре представлен анализ литературных данных по методам определения индивидуальных аминокислот в биологических жидкостях. Показано, что определение аминокислот можно проводить спектрофотометрическими, электрохимическими методами, а также с использованием широкого набора биосенсоров, при этом предел обнаружения не уступает хроматографическим методам анализа.
Идентификаторы и классификаторы
Омиксные исследования представляют одно из перспективных направлений современной диагноcтики в контексте метаболома биологических жидкостей. Известно, что аминокислоты – это составная часть метаболома, вовлеченная едва ли не во все процессы организма человека [1, 2]. Помимо участия в биосинтезе белков, аминокислоты выполняют многочисленные функции; они входят в состав предшественников биоактивных соединений, нейромедиаторов, гормонов, являются индукторами пролиферативных реакций, а также, регуляторами иммунного ответа и ионного равновесия в клетках [3, 4]. Аминокислоты имеют важное значение в функционировании нервной системы, оказывая нейротрофические и нейропротекторные эффекты. Так, глутаминовая, аспарагиновая кислота, а также глицин, выступая в роли нейромедиаторов, действуют на синаптические рецепторы, вызывая возбуждение или торможение нейронов [5, 6]. Аминокислоты служат источником энергии для клеток (например, валин, лейцин, изолейцин и глутамин). Серосодержащие аминокислоты – метионин, цистеин – являются донорами серы (SH- и SO3H-групп), достаточное содержание которой в организме способствует полноценному формированию волос, кожи и ногтей. Эти аминокислоты принимают участие в формировании вторичной структуры белков за счет образования дисульфидных мостиков [7]. Аланин – это важный источник энергии для головного мозга и центральной нервной системы; эта аминокислота также участвует в метаболизме глюкозы, регулируя уровень сахара в крови. Гистидин – одна из незаменимых α-аминокислот, которая выполняет ряд важных функций в организме человека: входит в состав активных центров многих ферментов, служит субстратом для синтеза биологически активных веществ, гормонов и некоторых пигментов (меланин) и участвует в синтезе белков. Триптофан – активный участник многих биологических процессов, метаболизм которого существенно влияет на здоровье человека [8]. Изменения концентрации триптофана в организме связаны с онкологическими заболеваниями, инфекциями, стрессом и депрессией [9, 10]. Незаменимая аминокислота фенилаланин по одному из своих основных путей метаболизма образует тирозин. В свою очередь, тирозин используется в разных тканях для синтеза катехоламинов (дофамин, норадреналин, адреналин), йодтиронинов (тироксин, трийодтиронин) и пигмента меланина [11].
Список литературы
1. Ershov, Yu.A. Fundamentals of molecular diagnostics. Metabolomics. Moscow: GEOTAR-Media, 2016. 336 p.
2. Lomova, N.A., Chagovets, V.V., Dolgopolova, E.L., Novoselova, A.V., Petrova, U.L., Shmakov, R.G., Frankevich, V.E. (2022) Alteration of the amino acid profile in the mother–fetus system in COVID-19. Vestnik RGMU, 3, 53-63. DOI: 10.24075/vrgmu.2022.025
3. Pogorelova, T.N., Gunko, V.O., Nikashina, A.A., Mikhelson, A.A., Mikhelson, A.F., Lebedenko, E.Yu., Alliluyev, I.A. (2018) The influence of amino acid imbalance in the mother and fetus on the formation of placental insufficiency and the course of the neonatal period. Klinicheskaya Laboratornaya Diagnostika, 63(10), 610-614. DOI: 10.18821/0869-2084-2018-63-610-614
4. Wu, G. 2(010) Functional amino acids in growth, reproduction, and health. Advances in Nutrition, 1(1),31-7. DOI: 10.3945/an.110.1008
5. Okonenko, T.I., Kartysheva, K.Yu., Antropova, G.A., Novikova, A.P. (2022) Physiological mechanisms of replaceable proteinogenic amino acids and their importance for neurology. Vestnik NovGU. Meditsinskiye Nauki, 4(129), 61–65. DOI: 10.34680/2076-8052.2022.4(129).61-65
6. Madzhidova, E.N., Rasulova, H.A., Ziyavitdinov, J.F. (2010) Features of the amino acid composition of cerebrospinal fluid and blood serum in patients with acute ischemic stroke. Nervnyye BOLEZNI, 4, 23-26.
7. Townsend, D.M., Tew, K.D., Tapiero, H. (2004) Sulfur containing amino acids and human disease. Biomed. Pharmacother., 58(1), 47-55. DOI: 10.1016/j.biopha.2003.11.005.
8. Friedman, M. (2018) Analysis, Nutrition, and Health Benefits of Tryptophan. International Journal of Tryptophan Research, 11, 1178646918802282. DOI: 10.1177%2F1178646918802282
9. Lanser, L., Kink, P., Egger, E.M., Willenbacher, W., Fuchs, D., Weiss, G., et al. (2020) Inflammation-induced tryptophan breakdown is related with anemia, fatigue, and depression in cancer. Front. Immunol., 11, 249. DOI: 10.3389/fimmu.2020.00249
10. Lee, H.O., Uzzo, R.G., Kister, D., Kruger, W.D. (2017) Combination of serum histidine and plasma tryptophan as a potential biomarker to detect clear cell renal cell carcinoma. J Transl. Med., 15(1), 72. DOI: 10.1186/s12967-017-1178-8
11. Krivova, A.V., Kozhevnikova, M.V., Korobkova, E.O., Zektser, V.Yu., Zheleznykh, E.A., Ageyev, A.A., Moskaleva, N.E., Kukharenko, A.V., Appolonova, S.A., Belenkov, Yu.N. (2022) Aromatic amino acids: phenylalanine and tyrosine in patients with arterial hypertension and ischemic heart disease. Ratsional’naya Farmakoterapiya v Kardiologii, 18(3), 297-305. DOI:10.20996/1819-6446-2022-06-05
12. Scholl-Bürgi, S., Sass, J.O., Heinz-Erian, P., Amann, E., Haberlandt, E., Albrecht, U., Ertl, C., Sigl, S.B., Lagler, F., Rostasy, K., Karall, D. (2010) Changes in plasma amino acid concentrations with increasing age in patients with propionic acidemia. Amino Acids, 38(5), 1473-81. DOI: 10.1007/s00726-009-0356-2
13. Narezhnaya, E.V., Krukier, I.I., Avrutskaya, V.V., Nikashina, A.A., Serkova, S.V. (2013) Determination of the level of l-citrulline in amniotic fluid in women with physiological pregnancy by capillary electrophoresis. Klinicheskaya Laboratornaya Diagnostika, 1, 39-41.
14. Amosova, O.E., Mashina, E.V., Shanina, S.N. (2020) Amino acids as biomarkers of phase composition of choleliths. Vestnik Instituta Geologii Komi NTS UrO RAN, 10(310), 22-30. DOI: 10.19110/geov.2020.10.3
15. Reddy, I.; Sherlin, H.J.; Ramani, P.; Premkumar, P.; Natesan, A.; Chandrasekar, T. (2012) Amino acid profile of saliva from patients with oral squamous cell carcinoma using high performance liquid chromatography. J Oral Sci, 54(3), 279-283. DOI: 10.2334/josnusd.54.279
16. de Sá Alves, M., de Sá Rodrigues, N., Bandeira, C.M. et al. (2021) Identification of possible salivary metabolic biomarkers and altered metabolic pathways in south american patients diagnosed with oral squamous cell carcinoma. Metabolites 11, 650. DOI: 10.3390/metabo11100650
17. García-Villaescusa, A., Morales-Tatay, J.M., Monleón-Salvadó, D., González-Darder, J.M., Bellot-Arcis, C., Montiel-Company, J.M., Almerich- Silla, J.M. (2018) Using NMR in saliva to identify possible biomarkers of glioblastoma and chronic periodontitis. PLoS ONE, 13 (2), e0188710. DOI: 10.1371/journal.pone.0188710
18. Hershberger, C.E., Rodarte, A.I., Siddiqi, S., Moro, A., Acevedo-Moreno, L.A., Brown, J.M., Allende, D.S., Aucejo, F., Rotroff, D.M. (2021) Salivary Metabolites are Promising Non-Invasive Biomarkers of Hepatocellular Carcinoma and Chronic Liver Disease. Liver Cancer Int., 2 (2), 33-44. DOI: 10.1002/lci2.25
19. Takamori, S., Ishikawa, S., Suzuki, J., Oizumi, H., Uchida, T., Ueda, S., damatsu, K., Iino, M., Sugimoto, M. (2022) Differential diagnosis of lung cancer and benign lung lesion using salivary metabolites: A preliminary study. Thorac. Cancer, 13 (3), 460-465. DOI: 10.1111/1759-7714.14282
20. Muller Bark, J., Karpe, A.V., Doecke, J.D., Leo, P., Jeffree, R.L., Chua, B., Day, B.W., Beale, D.J., Punyadeera. C. (2023) A pilot study: Metabolic profiling of plasma and saliva samples from newly diagnosed glioblastoma patients. Cancer Med., 12(10), 11427-11437. DOI: 10.1002/cam4.5857
21. Cheng, F., Wang, Z., Huang, Y., Duan, Y., Wang, X. (2015) Investigation of salivary free amino acid profile for early diagnosis of breast cancer with ultra performance liquid chromatography-mass spectrometry. Clin. Chim. Acta, 20(447), 23-31. DOI:10.1016/j.cca.2015.05.008
22. Hasan, M.M., Razu, M.H., Akter, S., Mou, S.A., Islam, M., Khan, M. (2024) Development and validation of a non-invasive method for quantifying amino acids in human saliva. RSC Adv., 14(31), 22292-22303. DOI: 10.1039/d4ra01130a
23. Vorozheikin, S.B., Vorozheikina, S.S. (2008) Amino acids: main achievements of methods for their analysis and separation. Vestnik IKIAT, 2(17), 163-168.
24. Kaur, J., Rangra, N.K., Chawla, P.A. (2023) A comprehensive review on recent trends in amino acids detection through analytical techniques. Separation Science Plus, 6(11), 2300040. DOI: 10.1002/sscp.202300040
25. Gałęzowska, G., Ratajczyk, J., Wolska, L. (2021) Determination of amino acids in human biological fluids by high-performance liquid chromatography: critical review. Amino Acids, 53(7), 993-1009. DOI: 10.1007/s00726-021-03002-x
26. Magerramova, L.M., Dzhafarova, N.A., Suleimanova, E.I. (2023) Methods of physicochemical analysis for the determination of tryptophan. Vestnik KNII RAN. Seriya «Yestestvennyye i Tekhnicheskiye Nauki», 2(13), 48-57. DOI: 10.34824/VKNIIRAN.2023.13.2.006
27. Hasani, M., Yaghoubi, L., Abdollahi, H. (2007) A kinetic spectrophotometric method for simultaneous determination of glycine and lysine by artificial neural networks. Anal. Biochem., 365(1), 74-81. DOI: 10.1016/j.ab.2007.02.010
28. Nikolaeva, E.A., Mamedov, I.S., Zolkina, I.V. (2011) Modern technologies for diagnosing hereditary diseases of amino acid metabolism. Rossiyskiy Vestnik Perinatologii i Pediatrii, 4, 20-30.
29. Danilova, L.A. Biochemistry. St. Petersburg: SpetsLit, 2020, 333 p..
30. Eid S.M., Farag M.A., Bawazeer S. (2022) Underivatized amino acid chromatographic separation: optimized conditions for hplc-uv simultaneous quantification of isoleucine, leucine, lysine, threonine, histidine, valine, methionine, phenylalanine, tryptophan, and tyrosine in dietary supplements. ACS Omega, 7(35), 31106-31114. DOI: 10.1021/acsomega.2c03228
31. Casetta, B, Tagliacozzi, D, Shushan, B, Federici, G. (2000) Development of a method for rapid quantitation of amino acids by liquid chromatographytandem mass spectrometry (LC-MSMS) in plasma. Clin. Chem. Lab. Med., 38(5), 391-401. DOI: 10.1515/CCLM.2000.057
32. Song, Y, Xu, C, Kuroki, H, Liao, Y, Tsunoda, M. (2018) Recent trends in analytical methods for the determination of amino acids in biological samples. J. Pharm. Biomed. Anal., 147, 35-49. DOI: 10.1016/j.jpba.2017.08.050
33. Tush, E.V., Eliseeva, T.I., Khaletskaya, O.V., Krasilnikova, S.V., Ovsyannikov, D.Yu., Potemina, T.E., Ignatov, S.K. (2019) Markers of the state of the extracellular matrix and methods of their study (review). Sovremennyye Tekhnologi v Meditsine, 2, 133-149. DOI: 10.17691/stm2019.11.2.20
34. Salamatov, A.A., Simonyan, A.V., Pokrovskaya, Yu.S., Avanesyan, A.A. (2007) Development of an accessible method for the quantitative determination of α-amino acids. Volgogradskiy Nauchno-Meditsinskiy Zhurnal, 2, 17-19.
35. Suleymanova, E.I. (2023) Application of the spectrophotometric method for the determination of amino acids. Vestnik Bashkirskogo Universiteta, 28(1), 100-104. DOI: 10.33184/bulletin-bsu-2023.1.15
36. Nashchekina, Yu.A., Kurdyukova, K.E., Zorin, I.M., Mikhailova, N.A., Bilibin, A.Yu. (2018) Spectrophotometric determination of L-lysine concentration in aqueous organic solutions. Zhurnal Tekhnicheskoy Fiziki, 9(88), 13843-1386. DOI: 10.21883/JTF.2018.09.46425.31-18
37. Qadri, S., Rathod, I., Kanakia, D. (2007) Colorimetry method for estimation of glycine, alanine and isoleucine. Indian Journal of Pharmaceutical Sciences, 69(3), 345–366. DOI: 10.4103/0250-474X.34566
38. Nergiz, M., Zenger, O., Peşint, G.B. (2024) L-proline determination by molecularly imprinted nanoparticles: A potential nanoscale tool for the diagnosis of metabolic disorders. J. Chromatogr. A, 1730, 465106. DOI: 10.1016/j.chroma.2024.465106
39. Berketa, К., Saiapina, О., Fayura, L., Sibirny, A., Dzyadevych, S., Soldatkin, O. (2022) Novel highly sensitive conductometric biosensor based on arginine deiminase from Mycoplasma hominis for determination of arginine. Sensors & Actuators: B. Chemical, 367, 132023 DOI: 10.1016/j.snb.2022.132023
40. Lavanya, R., Poovarasan, S., Srinivasadesikan, V., Lin, M.-c., Padmini, V. (2023) Selective fluorescence turn-off detection of lysine by a curcumin derivative with real sample analysis. Journal of Photochemistry&Photobiology, A: Chemistry, 444: 115008. DOI: 10.1016/j.jphotochem.2023.115008
41. Pundir, C.S., Nohwal, B., Chaudhary, R. (2021) A comprehensive review of methods for determination of l-lysine with detailed description of biosensors. Int. J. Biol. Macromol., 1:186:445-461. DOI: 10.1016/j.ijbiomac.2021.07.010
42. Kugimiya, A, Takamitsu, E. (2013) Spectrophotometric detection of histidine and lysine using combined enzymatic reactions. Mater. Sci. Eng. C Mater. Biol. Appl., 33(8), 4867-70. DOI: 10.1016/j.msec.2013.08.004
43. Chernova, R.K., Varygina, O.V., Berezkina, N.S. (2015) Selective determination of histidine in mixed solutions of α-amino acids. Izvestiya Saratovskogo Universiteta. Novaya Seriya. Seriya Khimiya. Biologiya. Ekologiya, 4, 15-21.
44. Vecchione, G., Margaglione, M., Grandone, E., Colaizzo, D., Cappucci, G., Fermo, I., D’Angelo, A., Di Minno, G. (1999) Determining sulfur-containing amino acids by capillary electrophoresis: a fast novel method for total homocyst(e)ine human plasma. Electrophoresis, 20(3), 569-74. DOI:10.1002/ (SICI)1522-2683(19990301)20:3<569:AID-ELPS569>3.0.CO;2-S
45. Lochman, P., Adam, T., Friedecký, D., Hlídková, E., Skopková, Z. (2003) High-throughput capillary electrophoretic method for determination of total aminothiols in plasma and urine. Electrophoresis, 24(7-8), 1200-7. DOI:10.1002/elps.200390154
46. Belskaya, L.V., Sarf, E.A. (2024) Application of the capillary electrophoresis method for the quantitative determination of tryptophan in the saliva of breast cancer patients. Klinicheskaya Laboratornaya Diagnostika, 69(4), 117-122. DOI: 10.51620/0869-2084-2024-69-4-117-122
47. Wentao, Y., Zhang, H., Chen, G., Chunyan, T. (2004) Novel method for spectrophotometric determination of l-tryptophan in the enzymatic resolution of dl-n-acetyl-tryptophan. Microchimica Acta, 146, 285-290. DOI: 10.1007/s00604-004-0180-z
48. Hosokawa, Sh., Morinishi, T., Ohara, K., Yamaguchi, K. (2023) A spectrophotometric method for the determination of tryptophan following oxidation by the addition of sodium hypochlorite pentahydrate. PLOS One, 18(1), 3-10. DOI: 10.1371/journal.pone.0279547
49. Gavrilov, V.B., Lobko, N.F., Konev, S.V. (2004) Determination of tyrosine and tryptophan-containing peptides in blood plasma by absorption in the UV spectral region. Klinicheskaya Laboratornaya Diagnostika, 3, 12-16.
50. Kavitha, C., Bramhaiah, K., John, N.S. (2020) Low-cost electrochemical detection of l-tyrosine using an rGO-Cu modified pencil graphite electrode and its surface orientation on an Ag electrode using an ex situ spectroelectrochemical method. RSC Adv, 10(39):22871-22880. DOI: 10.1039/d0ra04015k
51. Liu, M., Lao, J., Wang, H., Su, Z., Liu, J., Wen, L., Yin, Z., Luo, Q., Peng, H. (2021) Electrochemical determination of tyrosine on glassy carbon electrode modified with graphene composite and gold nanoparticles. Elektrokhimiya, 57(1), 47-58. DOI: 10.31857/S0424857020110067
52. Aravin, O.I., Novikov, A.Yu., Selifonova, E.I., Chernova, R.K., Shevyrev, S.P. (2011) Application of the artificial neural network method for determining some amino acids in binary mixtures. Izvestiya Saratovskogo Universiteta. Novaya Seriya. Seriya Matematika. Mekhanika. Informatika, 1, 105-111
53. Petrova, Y.Yu. (2010) A sorption-catalytic procedure for determining histamine. Journal of Analytical Chemistry, 65(5), 525-534. DOI: 10.1134/S1061934810050151
54. Beklemishev, M.K., Petrova, Yu.Yu., Abramova, O.M., Dolmanova, I.F. (2003) Sorption-catalytic method for determining nitrogen-containing organic compounds. Vestnik Moskovskogo Universiteta. Seriya 2. Khimiya, 44(2), 115-122.
55. Suleymanova, E.I. (2023) Application of physical and chemical methods of analysis for the determination of alanine. Vestnik Bashkirskogo Universiteta, 28(2), 206-210. DOI: 10.33184/bulletin-bsu-2023.2.11
56. Arzumanyan, V.G., Foshina, E.P., Ozhovan, I.M., Iksanova, A.M., Kolyganova, T.I., Mironov, A.Yu. (2021) Method for determining salivary histatins. Klinicheskaya Laboratornaya Diagnostika, 66(6), 358-363. DOI: 10.51620/0869-2084-2021-66-6-358-363
57. Kolbasova, E.A., Kiseleva, N.I., Naumov, A.V. (2021) Sulfur-containing amino acids and their derivative metabolites in postmenopausal women with menopausal syndrome. Vestnik VGMU, 1, 72-80. DOI: 10.22263/2312-4156.2021.1.72
58. Maistrenko, V.N., Ilyasova, R.R., Kudasheva, F.Kh., Sadretdinov, M.A., Maistrenko, T.V. (2008) Quantitative analysis of α-amino acids in the urine of neurosurgical patients using thin layer chromatography on Armsorb plates. Vestnik Bashkirskogo Universiteta, 13(2), 265-298.
59. Xiao-Lan, Y., Ning, X., Yong, H., Guang, P., Xue, Y., Fen, X. (2014) Research progress and application prospect of near-infrared spectroscopy in analysis of food amino acid. Chinese, 34(9), 2377-81. DOI: 10.3964/j.issn.1000-0593(2014)09-2377-05
60. Guzova, V.A., Stroganova, E.A. (2024) Application of IR spectroscopy method for detection of tyrosine obtained from metabolites. Vestnik Nauki, 6(75), 1916-1921.
61. Aitekenov, S., Sultangaziyev, A., Abdirova, P., Yussupova, L., Gaipov, A., Utegulov ,Z., Bukasov, R. (2023) Raman, Infrared and Brillouin Spectroscopies of Biofluids for Medical Diagnostics and for Detection of Biomarkers. Crit. Rev. Anal. Chem., 53(7), 1561-1590. DOI: 10.1080/10408347.2022.2036941
62. Gordetsov, A.S. (2010) Infrared spectroscopy of biological fluids and tissues. Sovremennyye Tekhnologii v Meditsine, 1,84-98.
63. Kazarina, L.N., Gordetsov, A.S., Smetanina, O.A., Krasnikova, O.V. (2017) Diagnosis and prevention of gingivitis using the method of infrared spectroscopy of biological fluids of the oral cavity. Vyatskiy Meditsinskiy Vestnik, 3(55), 60-63. DOI: 10.25636/PMP.2.2018.4.14
64. Belskaya, L.V., Sarf, E.A., Solomatin, D.V. (2019) Quantitative determination of lipid content in biological material using infrared spectroscopy. Klinicheskaya Laboratornaya Diagnostika, 64(4), 204-209. DOI: 10.18821/0869-2084-2019-64-4-204-209
65. Wolpert, M, Hellwig, P. (2006) Infrared spectra and molar absorption coefficients of the 20 alpha amino acids in aqueous solutions in the spectral range from 1800 to 500 cm(-1). Spectrochim. Acta A Mol. Biomol. Spectrosc., 64(4), 987-1001. DOI: 10.1016/j.saa.2005.08.025
Выпуск
Другие статьи выпуска
DUSP9/MKP-4 принадлежит к семейству биспецифических протеинфосфатаз, негативно регулирующих MAP-киназы (ERK, p38 и JNK). Экспрессия DUSP9 значительно (20-80-кратно) снижена по сравнению c нормальной тканью в 95% исследованных образцов почечно-клеточной карциномы человека. Эти и другие научные данные указывают на то, что DUSP9 является привлекательной мишенью для использования в клинической практике. Однако до сих пор единственным источником клинического материала для исследования экспрессии DUSP9 служили постоперационные биопсийные образцы опухоли. Это значительно ограничивает возможности использования DUSP9 в клинических целях. Целью настоящей работы была оценка возможности обнаружения DUSP9 в моче человека. В работе использовали клетки карциномы почки человека ACHN, трансфицированные DUSP9-экспрессирующим вектором, и образцы мочи 3 здоровых добровольцев. DUSP9 белок детектировали, используя метод Вестерн-блота в лизатах осадков, полученных методом центрифугирования. Мы показали, что белок DUSP9 содержится в осадке фракции мочи, полученной при низкоскоростном центрифугировании (10000 g). Также он присутствует во фракции внеклеточных везикул, обогащенных экзосомами. Полученный результат свидетельствует о том, что анализ экспрессии DUSP9 возможен с помощью жидкостной биопсии. Это может существенно расширить применимость этого анализа в клинических целях.
Выявлена высокая цитотоксическая активность (Z)-(2-(2-Гидрокси-5-хлорфенил)-2-фенилэтенил)алкилдифенилфосфоний хлоридов на уровне препарата сравнения доксорубицина. Протестированные фосфониевые соли в большинстве случаев оказались менее токсичными в отношении условно-нормальных клеточных линий. На примере соединения РР8, содержащего октильный радикал при атоме фосфора, показана частичная остановка клеточного цикла в фазе G1, усиленная генерация активных форм кислорода, а также индукция митохондриального апоптоза опухолевых клеток M-HeLa. Экспериментальные данные подтверждаются повышенным уровнем белков р53, р21, H2A. X и каспазы-9, обнаруженным с помощью мультиплексного анализа, и свидетельствуют о возникновении двухцепочечных разрывов ДНК в результате воздействия исследованного соединения. Таким образом, дальнейшие структурные модификации с целью повышения селективности исследуемых соединений позволят рассматривать их в качестве платформы для создания новых эффективных химиотерапевтических агентов.
Целью исследования было изучение адъювантных свойств хитозана в сравнении с гидроксидом алюминия при иммунизации рекомбинантными белками Pseudomonas aeruginosa. В работе использовали рекомбинантный белок F наружной мембраны (OprF) и рекомбинантный анатоксин P. aeruginosa, к которым добавляли 0.5% препарат хитозана, растворенный в глутаминовой кислоте с pH 5.0 или гель гидроксида алюминия. Испытали соотношение гидроксида алюминия к белку 3:1 и 1:1, а хитозан добавляли в количестве 100 мкг и 50 мкг для одной иммунизирующей дозы. При иммунизации препараты вводили мышам внутрибрюшинно двукратно с двухнедельным интервалом, а затем через две недели животных заражали внутрибрюшинно P. aeruginosa (РА-103), подсчитывая погибших и выживших животных. Иммунизация рекомбинантным белком OprF в дозе 25 мкг и рекомбинантным анатоксином в дозе 50 мкг как с гидроксидом алюминия, так и с хитозаном, способствовала развитию равнозначных протективных свойств. При комплексном введении двух рекомбинантных белков было выявлено усиление защитных свойств с использованием обоих адъювантов. Исследовали возможность применения рекомбинантных антигенов без адъюванта и уменьшения их иммунизирующей дозы при бустерной иммунизации. Снижение иммунизирующей дозы в два раза при повторном введении не уменьшило протективный эффект, а в случае хитозана, приводило к усилению иммунного ответа при бустерной иммунизации рекомбинантными антигенами без адъюванта. Таким образом, для рекомбинантных белков P. aeruginosa выявлены адъювантные свойства хитозана, не уступающие по индукции протективных свойств гидроксиду алюминия.
Показано, что эффективность иммунного ответа в виде продукции специфичных антител против иммуногенных пептидных конструкций, составленных из консервативных фрагментов оболочечного белка Е2 вируса гепатита С, зависит от использованных в составе препаратов адъювантов и носителей. Наиболее эффективное образование специфичных антител отмечено в ответ на введение пептидных конструкций, содержащих В- и Т-эпитопы белка Е2, конъюгированных с носителем с адъювантными свойствами Иммуномаксом. Антитела, полученные в ответ на иммунизацию конъюгатами пептидных конструкций с Иммуномаксом, связывали оболочечный белок Е2 и гетеродимер оболочечных белков Е1Е2 вируса гепатита С.
Статистика статьи
Статистика просмотров за 2025 - 2026 год.
Издательство
- Издательство
- ИБМХ
- Регион
- Россия, Москва
- Почтовый адрес
- 119121, Россия, г. Москва, ул. Погодинская, д. 10, стр.8
- Юр. адрес
- 119121, Россия, г. Москва, ул. Погодинская, д. 10, стр.8
- ФИО
- Пономаренко Елена Александровна (Директор)
- E-mail адрес
- dir@ibmc.msk.ru
- Контактный телефон
- +7 (499) 2466980