В клиническом случае представлена женщина 42 лет с дефицитом липопротеинлипазы, развившимся из-за генетических вариантов в гене LPL в компаунд-гетерозиготном положении и способствующим развитию тяжелой гипертриглицеридемии (ГТГ). В данной публикации обсуждаются клинические особенности, патогенез, диагностика и лечение ГТГ, а также рассматриваются механизмы, посредством которых триглицериды (ТГ) способствуют развитию атеросклероза и острого панкреатита.
Идентификаторы и классификаторы
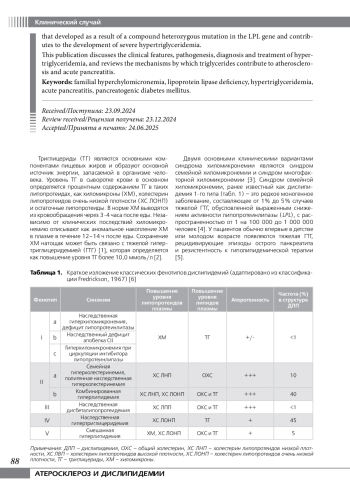
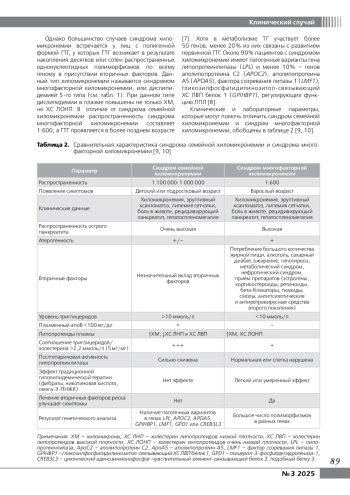
Триглицериды (ТГ) являются основными компонентами пищевых жиров и образуют основной источник энергии, запасаемой в организме человека. Уровень ТГ в сыворотке крови в основном определяется процентным содержанием ТГ в таких липопротеидах, как хиломикроны (ХМ), холестерин липопротеидов очень низкой плотности (ХС ЛОНП) и остаточные липопротеиды. В норме ХМ выводятся из кровообращения через 3-4 часа после еды. Независимо от клинических последствий хиломикронемию описывают как аномальное накопление ХМ в плазме в течение 12–14 ч после еды. Сохранение ХМ натощак может быть связано с тяжелой гипертриглицеридемией (ГТГ) [1], которая определяется как повышение уровня ТГ более 10,0 ммоль/л [2].
Список литературы
. D’Erasmo L, Di Costanzo A, Cassandra F, Minicocci I, Polito L, Montali A, et al. Spectrum of Mutations and Long-Term Clinical Outcomes in Genetic Chylomicronemia Syndromes. Arterioscler Thromb Vasc Biol J. 2019;39(12):2531-2541. DOI: 10.1161/atvbaha.119.313401
2. Ginsberg HN, Packard CJ, Chapman MJ, Borén J, Aguilar-Salinas CA, Averna M. et al. Triglyceride-rich lipoproteins and their remnants: metabolic insights, role in atherosclerotic cardiovascular disease, and emerging therapeutic strategies-a consensus statement from the European Atherosclerosis Society. Eur Heart J. 2021;42(47):4791-4806. DOI: 10.1093/eurheartj/ehab551
3. Chait A, Eckel RH. The Chylomicronemia Syndrome Is Most Often Multifactorial: A Narrative Review of Causes and Treatment. Ann Intern Med J. 2019;170(9):626-634. DOI: 10.7326/M19-0203
4. Brahm AJ, Hegele RA. Chylomicronaemia - current diagnosis and future therapies. Nat Rev Endocrinol J. 2015;11(6):352-362. DOI: 10.1038/nrendo.2015.26
5. Moulin P, Dufour R, Averna M, Arca M, Cefalщ AB, Noto D. et al. Identification and diagnosis of patients with familial chylomicronaemia syndrome (FCS): Expert panel recommendations and proposal of an “FCS score”. Atherosclerosis J. 2018;275:265-272. DOI: 10.1016/j.atherosclerosis.2018.06.814
6. Ezhov MV. Kukharchuk VV, Sergienko IV. Alieva AS, Antsiferov MB, Ansheles AA, et al. Lipid Metabolism Disorders. Clinical Guidelines 2023.Russian Journal of Cardiology. 2023;28(5):5471. In Russian.
Ежов М.В, Кухарчук В.В, Сергиенко И В, Алиева А.С, Анциферов МБ, Аншелес А.А. и др. Нарушения липидного обмена. Клинические рекомендации 2023. Российский кардиологический журнал. 2023;28(5):5471). DOI: 10.15829/1560-4071-2023-5471
7. Goldberg RB, Chait A. A Comprehensive Update on the Chylomicronemia Syndrome. Front Endocrinol (Lausanne) J. 2020;11:593931. DOI: 10.3389/fendo.2020.593931
8. Hegele RA, Berberich AJ, Ban MR, Wang J, Digenio A, Alexander VJ.et al. Clinical and biochemical features of different molecular etiologies of familial chylomicronemia. J Clin Lipidol. 2018;12(4):920-927 e4.
9. Paragh G, Németh Б, Harangi M, Banach M. Fblöp P. Causes, clinical findings and therapeutic options in chylomicronemia syndrome, a special form of hypertriglyceridemia. Li pids Health Dis J. 2022;21(1):21. DOI: 10.1186/s12944-022-01631-z
10. Bashir B, Ho JH, Downie P, Hamilton P, Ferns G, Datta D, et al. Severe Hypertriglyceridaemia and Chylomicronaemia Syndrome-Causes, Clinical Presentation, and Therapeutic Options. Metabolites J. 2023;13(5):621. DOI: 10.3390/metabo13050621
11. Hegele RA. Is Genetic Testing in Hypertriglyceridemia Useful? Arterioscler Thromb Vasc Biol J. 2022;42(12):1468-1470. DOI: 10.1161/ATVBAHA.122.318621
12. Sandhu S, Al-Sarraf A, Taraboanta C, Frohlich J, Francis GA. Incidence of pancreatitis, secondary causes, and treatment of patients referred to a specialty lipid clinic with severe hypertriglyceridemia: a retrospective cohort study. Lipids Health Dis J. 2011;10:157. DOI: 10.1186/1476-511X-10-157
13. Richards S, Aziz N, Bale S, Bick D, Das S, Gastier-Foster J, et al. ACMG Laboratory Qual ity Assurance Committee. Standards and guidelines for the interpretation of sequence variants: a joint consensus recommendation of the American College of Medical Genetics and Genomics and the Association for Molecular Pathology. Genet Med J. 2015;17(5):405-424. DOI: 10.1038/gim.2015.30
14. Ryzhkova OP, Kardymon OL, Prohorchuk EB, Konovalov FA, Maslennikov AB, Stepanov VA, et al. Guidelines for the interpretation of massive parallel sequencing variants (update 2018, v2). Medical genetics J. 2019;18(2):3-24. In Russian.
Рыжкова О.П, Кардымон О.Л, Прохорчук Е.Б., Коновалов ФА, Масленников А.Б., Степанов В.А. и др. Руководство по интерпретации данных последовательности ДНК человека, полученных методами массового параллельного секвенирования (MPS) (редакция 2018, версия 2). Медицинская генетика. 2019;18(2):3-23) doi: 1025557/2073-7998.201902.3-23.
15. Packard CJ, Boren J, Taskinen MR. Causes and Consequences of Hypertriglyceridemia. Front Endocrinol (Lausanne) J. 2020;11:252. DOI: 10.3389/fendo.2020.00252
16. Santos-Baez LS, Ginsberg HN. Hypertriglyceridemia-Causes, Significance, and Approaches to Therapy. Front Endocrinol (Lausanne) J. 2020;11:616. DOI: 10.3389/fendo.2020.00616
17. Nordestgaard BG, Varbo A. Triglycerides and cardiovascular disease. Lancet J. 2014;384(9943):626-635. DOI: 10.1016/S0140-6736(14)61177-6
18. Castelli WP. Epidemiology of triglycerides: a view from Framingham. Am J Cardiol. 1992;70(19):3H-9H. DOI: 10.1016/0002-9149(92)91083-g
19. Carey VJ, Bishop L, Laranjo N, Harshfield BJ, Kwiat C, Sacks FM. Contribution of high plasma triglycerides and low high-density lipoprotein cholesterol to residual risk of coronary heart disease after establishment of low-density lipoprotein cholesterol control. Am J Cardiol. 2010;106(6):757-763. DOI: 10.1016/j.amjcard.2010.05.002
20. Karlson BW, Palmer MK, Nicholls SJ, Lundman P, Barter PJ. A VOYAGER Meta-Analysis of the Impact of Statin Therapy on Low-Density Lipoprotein Cholesterol and Triglyceride Levels in Patients With Hypertriglyceridemia. Am J Cardiol. 2016;117(9):1444-1448. DOI: 10.1016/j.amjcard.2016.02.011
21. Vipperla K, Somerville C, Furlan A, Koutroumpakis E, Saul M, Chennat J, et al. Clinical Profile and Natural Course in a Large Cohort of Patients With Hypertriglyceridemia and Pancreatitis. J Clin Gastroenterol. 2017;51(1):77-85. DOI: 10.1097/MCG.0000000000000579
22. Valdivielso P, Rammez-Bueno A, Ewald N. Current knowledge of hypertriglyceridemic pancreatitis. Eur J Intern Med. 2014;25(8):689-694. DOI: 10.1016/j.ejim.2014.08.008
23. Zeng Y, Wang X, Zhang W, Wu K, Ma J. Hypertriglyceridemia aggravates ER stress and pathogenesis of acute pancreatitis. 2012;59(119):2318-2326. DOI: 10.5754/hge12042
24. Hollemans RA, Hallensleben NDL, Mager DJ, Kelder JC, Bessel ink MG, Bruno MJ, et al. Pancreatic exocrine insufficiency following acute pancreatitis: Systematic review and study level meta-analysis. Pancreatology J. 2018;18(3):253-262. DOI: 10.1016/j.pan.2018.02.009
25. Huang W, de la Iglesia-Garcrn D, Baston-Rey I, Calvico-Suarez C, Larim-Noia J, Iglesias-Garcia J, et al. Exocrine Pancreatic Insufficiency Following Acute Pancreatitis: Systematic Review and Meta-Analysis. Dig Dis Sci J. 2019;64(7):1985-2005. DOI: 10.1007/s10620-019-05568-9
26. American Diabetes Association. 2. Classification and Diagnosis of Diabetes: Standards of Medical Care in Diabetes-2020. Diabetes Care J. 2020;43(Suppl 1):S14-S31. DOI: 10.2337/dc20-S002
27. Hart PA, Bell in MD, Andersen DK, Bradley D, Cruz-Monserrate Z, Forsmark CE, et al. Type 3c (pancreatogenic) diabetes mellitus secondary to chronic pancreatitis and pancreatic cancer. Lancet Gastroenterol Hepatol J. 2016;1(3):226-237. DOI: 10.1016/S2468-1253(16)30106-6
28. Hart PA, Bradley D, Conwell DL, Dungan K, Krishna SG, Wyne K, et al. Diabetes following acute pancreatitis. Lancet Gastroenterol Hepatol J. 2021;6(8):668-675. DOI: 10.1016/S2468-1253(21)00019-
29. Tu J, Zhang J,Ke L, Yang Y, Yang Q, Lu G, et al. Endocrine and exocrine pancreatic insufficiency after acute pancreatitis: long-term follow-up study. BMC Gastroenterol J. 2017;17(1):114. DOI: 10.1186/s12876-017-0663-0
30. Zhi M, Zhu X, Lugea A, Waldron RT, Pandol SJ, Li L Incidence of New Onset Diabetes Mellitus Secondary to Acute Pancreatitis: A Systematic Review and Meta-Analysis. Front Physiol J. 2019;10:637. DOI: 10.3389/fphys.2019.00637
31. Gouni-Berthold I, Schwarz J, Berthold HK. Updates in Drug Treatment of Severe Hypertriglyceridemia. Curr Atheroscler Rep J. 2023;25(10):701-709. DOI: 10.1007/s11883-023-01140-z
32. Witztum JL, Gaudet D, Freedman SD, Alexander VJ, Digenio A, Williams KR. et al. Volanesorsen and Triglyceride Levels in Familial Chylomicronemia Syndrome. N Engl J Med. 2019;381(6):531-542. DOI: 10.1056/NEJMoa1715944
33. Gouni-Berthold I, Alexander VJ, Yang Q, Hurh E, Steinhagen-Thiessen E, Moriarty PM, et al. Efficacy and safety of volanesorsen in patients with multif actorial chylomicronaemia (COMPASS): a multicentre, double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Diabetes Endocrinol J. 2021;9(5):264-275. DOI: 10.1016/S2213-8587(21)00046-2
34. Witztum JL, Gaudet D, Area M, Jones A, Soran H, Gouni-Berthold I, et al. Volanesorsen and triglyceride levels in familial ehylomieronemia syndrome: Long-term efficacy and safety data from patients in an open-label extension trial. J Clin Lipidol. 2023;17(3):342-355. doi: 10.10l6/j.jael2023.09-010.
35. Tardif JC, Karwatowska-Prokopezuk E, Amour ES, Ballantyne CM, Shapiro MD, Moriarty PM, et al. Apolipoprotein C-III reduction in subjeets with moderate hypertriglyeeridaemia and at high eardiovaseular risk. Eur Heart J. 2022;43(14):1401-1412. DOI: 10.1093/eurheartj/ehab820
36. Hegele RA. Apolipoprotein C-III inhibition to lower triglyeerides: one ring to rule them all? Eur Heart J. 2022;43(14):1413-1415. DOI: 10.1093/eurheartj/ehab890
37. Sehwabe C,Seott R, Sullivan D, Baker J, Clifton P, Hamilton J. et al. RNA interferenee targeting apolipoprotein C-III with ARO-APOC3 in healthy volunteers mimies lipid and lipoprotein findings seen in subjeets with inherited apolipoprotein C-III defieieney. Eur Heart J. 2020;41(Suppl 2):3330. DOI: 10.1093/ehjei/ehaa946.3330
38. Watts GF, Sehwabe C,Seott R, Gladding PA, Sullivan D, Baker J,et al. RNA interferenee targeting ANGPTL3 for triglyeeride and eholesterol lowering: phase 1 basket trial eohorts. 2023;29(9):2216-2223. DOI: 10.1038/s41591-023-02494-2
39. Sahin GK, Gulen M, Aeehan S, Unlu N, Celik Y, Satar DA. et al. Aeute panereatitis due to hypertriglyeeridemia: Plasmapheresis versus medieal treatment. Turk J Emerg Med. 2023;23(2):111-118. DOI: 10.4103/tjem.tjem_276_22
40. Grupp C, Beekermann J, Köster E, Zewinger S, Knittel M, Walek T, et al. Relapsing and Progressive Complieations of Severe Hypertriglyeeridemia: Effeetive Long-Term Treatment with Double Filtration Plasmapheresis. Blood Purif J. 2020;49(4):457-467.
Выпуск
Другие статьи выпуска
Цель. Оценить взаимосвязь между функциональной социальной поддержкой (ФСП), и липидным профилем у пациентов с атеросклеротическими ССЗ, получающих терапию ингибиторами PCSK9 (алирокумаб).
Материалы и методы. В исследование были включены 113 пациентов – 78 (69,0%) мужчин и 35 (31,0%) женщин, которым по жизненным показаниям был назначен ингибитор PCSK9 алирокумаб. Средний возраст составил 60,8±9,0 лет. Перед началом терапии проводилась оценка клинических, лабораторных и демографических показателей, а также определялся уровень ФСП посредством опросника MSPSS. Липидный профиль (общий холестерин, ЛНП, ЛВП) измерялся на исходном уровне и повторно через 6 месяцев лечения. Для анализа данных использовались статистические методы: критерии Манна–Уитни и Вилкоксона для сравнения групп, критерий χ² для качественных показателей и мультивариантная регрессия Кокса для оценки факторов, влияющих на достижение целевых уровней ЛНП.
Результаты. Обе группы пациентов (с разным уровнем ФСП) продемонстрировали значительное снижение общего холестерина и ЛНП после 6 месяцев терапии, что подтверждает высокую эффективность алирокумаба. При этом статистически значимых различий в динамике липидного профиля между группами в зависимости от уровня ФСП выявлено не было. Мультивариантный анализ показал, что исходный уровень ЛНП является единственным статистически значимым предиктором достижения целевых значений ЛНП (ОР=0,47, p <0,001), тогда как влияние ФСП оказалось статистически незначимым (ОР=0,65, p=0,25).
Заключение. Полученные данные подтверждают эффективность алирокумаба в снижении уровней ЛНП у пациентов с дислипидемией независимо от уровня ФСП. Хотя ФСП может способствовать улучшению приверженности рекомендациям по здоровому образу жизни и коррекции поведенческих факторов риска, ее прямое влияние на терапевтический ответ оказалось незначительным в рамках проведенного исследования.
Обоснование. Сердечно-сосудистые заболевания (CCЗ) атеросклеротического генеза являются ведущей причиной смертности во всем мире. Наиболее распространенным наследственным нарушением липидного обмена, характеризующимся повышением концентрации холестерина липопротеидов низкой плотности и преждевременным развитием сердечно-сосудистых заболеваний атеросклеротического генеза, является семейная гиперхолестеринемия.
Цель. Изучить биохимические и молекулярно-генетические особенности пациентов очень высокого сердечно-сосудистого риска с подозрением на семейную гиперхолестеринемию и оценить параметры чувствительности и специфичности биохимических показателей липидного профиля.
Материалы и методы. Исследование включало 50 пациентов высокого и очень высокого сердечно-сосудистого риска в возрасте от 18 до 55 лет. Всем пациентам были проведены электрофорез липидов, определение аполипопротеинов и молекулярно-генетические исследования в лаборатории диагностики аутоиммунных заболеваний при Научно-методическом центре Минздрава России по молекулярной медицине ПСПбГМУ им. академ. И. П. Павлова
Результаты. Согласно результатам NGS-секвенирования в исследуемой группе патогенные варианты в генах LDLR и АРОВ были обнаружены в 10% и 4% случаев соответственно. MLPA-анализ для определения протяженных делеций и дупликаций гена LDLR не выявил структурных изменений. Наиболее высокой прогностической ценностью обладал биохимический показатель аполипопротеин В100.
Заключение. Дальнейшее исследование молекулярно-генетических и биохимических особенностей позволит персонализировать тактику ведения пациентов с семейной гиперхолестеринемией.
Цель. Оценить отдаленные результаты лечения повторного инфаркта миокарда (ИМ) у пациентов с тромбозом/стенозом в ранее установленном стенте или с нарушением проходимости коронарной артерии вне его на фоне прогрессирования атеросклероза.
Материалы и методы. Проведен анализ 195 историй болезни пациентов, получивших лечение повторного ИМ в НИИ СП им. И. И. Джанелидзе в 2018–2021 гг. Пациенты разделены на две группы: I – люди с нарушенной проходимостью стента, установленного в предыдущую госпитализацию; II – в текущую госпитализацию визуализировано сужение коронарной артерии вне ранее установленного стента. Группы по полу и возрасту статистически не отличались. Наблюдение за пациентами осуществлялось от 24 до 26 месяцев и проводилось посредством телефонного контакта. Полученные результаты статистически обработаны с использованием параметрических и непараметрических методов статистики.
Результаты и обсуждение. В отдаленном периоде острая декомпенсированная хроническая сердечная недостаточность развивалась чаще у пациентов с нарушенной проходимостью стента. Стенокардия напряжения в обеих группах встречалась одинаково часто и приблизительно у половины пациентов. Нефатальный ИМ, нестабильная стенокардия статистически значимо чаще диагностировались в группе нарушения проходимости коронарной артерии вне стента, установленного ранее. Летальность статистически выше как общая, так и за период наблюдения, у пациентов со стенозом/тромбозом стента.
Заключение. Пациенты имеют различный постгоспитальный период течения заболевания в зависимости от инфаркт-связанного стеноза коронарной артерии (в ранее установленном стенте либо вне его).
Цель. Определить на основе программ Всемирной организации здравоохранения (ВОЗ) «Регистр острого инфаркта миокарда» (РОИМ), MONICA динамику 8-летнего (2015- 2022 гг.) применения статинов у пациентов с первичным, повторным острым инфарктом миокарда (ИМ) до развития острого случая на амбулаторном этапе, в стационаре среди лиц 25-64 лет в мегаполисе Западной Сибири (г. Новосибирск).
Материалы и методы. Все случаи ИМ в Октябрьском и Кировском районах г. Новосибирска (350 тыс. жителей) среди лиц в возрасте 25-64 лет, поступивших в стационар в 2015–2022 гг. (n=3289), были проанализированы на предмет приема статинов в условиях реальной клинической практики на амбулаторном этапе до острого случая и в стационаре с использованием международных программ ВОЗ РОИМ, MONICA. Статистический анализ проводился с помощью критерия Хи-квадрат Пирсона (точного критерия Фишера) с помощью пакета статистических программ Python. Значения р <0,05 считались статистически значимыми.
Результаты. Анализ показал, что в Новосибирске, в двух районах (Кировском и Октябрьском) число пациентов с ИМ со статинотерапией в возрасте 25–64 лет амбулаторно: до первичного случая – незначительно; до повторного случая – колеблется от 0 до 70% в период 8-летнего мониторинга. Чаще всего преобладание приема статинов было в возрастной группе 45–54 лет у мужчин и женщин за весь период наблюдения в обоих районах. Причем в возрастных группах 45–54/55–64 лет прием статинов превалирует у женщин. За исследуемый период не отмечено существенной динамики в приеме статинов на амбулаторном этапе до развития первичного ИМ; при повторном – фрагментированная динамика.
Заключение. Установили, что число пациентов со статинотерапией в возрасте 25–64 лет амбулаторно до случая первичного ИМ незначительно и не отмечено существенной динамики в приеме статинов за исследуемый период; при повторном ИМ – фрагментированная динамика. Комбинированный анализ уровней ИЛ-6 и sgp130 не только углубляет понимание воспалительного компонента патогенеза атеросклероза, но и создает основу для персонализированных стратегий профилактики и лечения.
Цель. Оценить эффективность применения ингибиторов PCSK9 – алирокумаба и инклисирана у пациентов с низкой приверженностью к статинотерапии, не достигающих целевых значений ХС ЛНП.
Материалы и методы. Проведено наблюдательное сравнительное исследование с участием 58 пациентов с исходно низкой приверженностью к статинотерапии. Пациенты распределялись в группу терапии алирокумабом (n=29) и в группу терапии инклисираном (n=29) для достижения целевых значений ХС ЛНП. Предварительно выполнено комплексное лабораторное и инструментальное обследование пациентов. Далее через 1, 3, 9 месяцев были проведены контроль уровня липидов, оценка эффективности и безопасности терапии, а также оценка приверженности пациентов терапии.
Результаты. Через 1 мес после начала терапии ингибиторами PCSK9 было отмечено сопоставимое снижение уровней ХС ЛНП в обеих группах, после 9 мес терапии было выявлено, что в группе, получающей терапию инклисираном, уровень ХС ЛНП был достоверно ниже, чем в группе больных, получающих терапию алирокумабом (1,53 ммоль/л против 2,15 ммоль соответственно, при p <0,05). Через 3 и 9 мес наблюдения приверженность к терапии снизилась в большей степени в группе алирокумаба, где чаще наблюдалось увеличение количества пропущенных инъекций и увеличение частоты случаев несвоевременного введения препаратов. Имитационная модель оценки вероятности снижения приверженности пациентов терапии в течение 15 мес наблюдения показала достоверную разницу, что несомненно отразится на прогнозе пациентов. Приверженность к терапии в группе инклисирана намного выше из-за более редкого введения препарата. Таким образом, приверженность к терапии зависела от частоты введения препарата.
Заключение. На основании проведенного исследования можно сделать вывод, что применение инклисирана как препарата с необходимостью более редкого введения позволит у пациентов с низкой приверженностью к терапии с большей вероятностью достичь целевых значений ХС ЛНП и снизить в целом риск возникновения сердечно-сосудистых осложнений.
Цель: изучить влияние фиксированной комбинации розувастатин + эзетимиб на показатели липидного профиля, включая триглицерид-богатые липопротеиды, у пациентов различных клинических групп и оценить безопасность назначения данной терапии.
Материалы и методы. В исследование включены 166 пациентов с очень высоким сердечнососудистым риском, которые получали фиксированную комбинацию розувастатина и эзетимиба (Зенон®) в различных дозировках. Пациенты были разделены на группы в зависимости от исходной гиполипидемической терапии: без терапии, умеренная монотерапия статинами и высокоинтенсивная монотерапия статинами. Также пациенты были разделены в зависимости от наличия или отсутствия ишемической болезни сердца (ИБС), сахарного диабета 2 типа (СД2), гетерозиготной семейной гиперхолестринемии (геСГХС). Оценивались показатели липидного профиля (ОХС, ХС ЛНП, ТГ, ТБЛП) до и после лечения.
Результаты. У пациентов с геСГХС уровень ОХС, ХС ЛНП, ХС неЛВП был достоверно выше, чем у больных без геСГХС. На фоне терапии фиксированной комбинацией розувастатина и эзетимиба наблюдалось значительное снижение уровня ХС ЛНП: на 64,2% – у пациентов без предшествующей терапии, на 49,2% – у пациентов с предшествующей умеренной терапией статинами и на 46,5% – у пациентов с предшествующей высокоинтенсивной терапией статинами. Целевого уровня ХС ЛНП ≤1,4 ммоль/л достигли 34% пациентов. Уровень ТБЛП снизился на 75,4%, что может способствовать снижению риска развития АССЗ. Побочные эффекты, включая повышение уровня АЛТ, наблюдались у 2,9% пациентов. Комбинированная гиполипидемическая терапия (ГЛТ) значимо снизила долю пациентов с уровнем ТБЛП >1,0 ммоль/л, что должно повлиять на уменьшение заболеваемости и смертности от АССЗ.
Заключение. Фиксированная комбинация розувастатина и эзетимиба продемонстрировала высокую эффективность и безопасность для снижения уровня ХС ЛНП и других проатерогенных липидов. Результаты подчеркивают необходимость активного внедрения комбинированной гиполипидемической терапии в клиническую практику, особенно у пациентов с сердечно-сосудистыми заболеваниями (АССЗ) и геСГХС.
В возникновении и прогрессировании атеросклероза принимает участие множество разных клеток, среди которых моноциты/макрофаги относят к фундаментальным участникам. В связи с этим изучение функционирования моноцитов/макрофагов применительно к этому заболеванию представляет значительный интерес для исследователей, так как результаты проводимых работ могут послужить для разработки новых препаратов, направленных на профилактику заболеваний, обусловленных атеросклеротическим поражением артерий. В первой части обзора приведены современные данные, касающиеся классификации и функции моноцитов/макрофагов, во второй части – актуальные представления, касающиеся участия моноцитов/макрофагов в атерогенезе.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- НАЦИОНАЛЬНОЕ ОБЩЕСТВО ПО ИЗУЧЕНИЮ АТЕРОСКЛЕРОЗА
- Регион
- Россия, Москва
- Почтовый адрес
- 121552, г. Москва, ул. Академика Чазова, дом 15А
- Юр. адрес
- 115088, г Москва, Южнопортовый р-н, ул 2-я Машиностроения, д 17 стр 1, помещ I офис 52, ком 63
- ФИО
- Сергиенко Игорь Владимирович (ДИРЕКТОР)
- E-mail адрес
- igorcardio@mail.ru
- Контактный телефон
- +7 (495) 4147286
- Сайт
- https://noatero.ru/