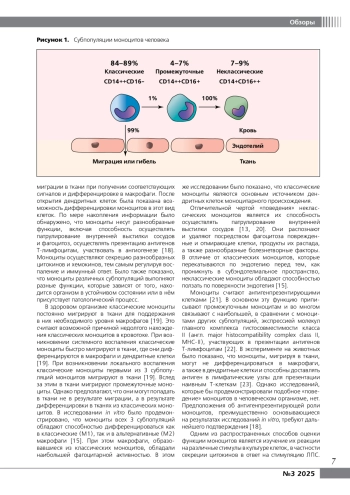
В возникновении и прогрессировании атеросклероза принимает участие множество разных клеток, среди которых моноциты/макрофаги относят к фундаментальным участникам. В связи с этим изучение функционирования моноцитов/макрофагов применительно к этому заболеванию представляет значительный интерес для исследователей, так как результаты проводимых работ могут послужить для разработки новых препаратов, направленных на профилактику заболеваний, обусловленных атеросклеротическим поражением артерий. В первой части обзора приведены современные данные, касающиеся классификации и функции моноцитов/макрофагов, во второй части – актуальные представления, касающиеся участия моноцитов/макрофагов в атерогенезе.
Идентификаторы и классификаторы
Моноциты представляют собой один из типов лейкоцитов и составляют 5–10% от общего количества лейкоцитов, циркулирующих в периферической крови [1]. Моноциты образуются из гемопоэтических клеток красного костного мозга. Сформировавшиеся в костном мозге моноциты попадают в кровоток. В нем одна часть моноцитов циркулирует в крови, другая часть находится пристеночно, образуя пристеночный пул [2]. Он включает около 60% от находящихся в крови моноцитов. Под влиянием различных факторов в течение нескольких минут большое количество моноцитов может переходить из пристеночного пула в циркулирующий и возвращаться обратно [3]. Моноциты являются короткоживущими клетками. Под влиянием разных хемотаксических факторов, например хемокина – моноцитарного хемоаттрактантного протеина 1 (англ. monocyte chemoattractant protein-1, МСР-1), также известного как хемокиновый (мотив C-C) лиганд 2 (англ. chemokine C-C motif ligand 2, CCL2), моноциты мигрируют в ткани, где они превращаются в макрофаги или дендритные клетки [4]. Моноциты, не мигрирующие в ткани, подвергаются апоптозу [5].
Список литературы
1. Tacke F, Randolph GJ. Migratory fate and differentiation of blood monocyte subsets. Immunobiology. 2006;211(6-8):609-6l8. DOI: 10.1016/j.imbio.2006.05.025
2. van Furth R, Sluiter W. Distribution of blood monocytes between a marginating and a circulating pool. J Exp Med. 1986;163(2):474-479-. DOI: 10.1084/jem.163-2A74
3. Klonz A, Wonigeit K, Pabst R, Westermann J. The marginal blood pool of the rat contains not only granulocytes, but also lymphocytes, NK-cells and monocytes: a second intravascular compartment, its cellular composition, adhesion molecule expression and interaction with the peripheral blood pool. Scand J Immunol. 1996;44(5):461-469. DOI: 10.1046/j.1365-3083.1996.d01-334.x
4. Deshmane SL, Kremlev S, Amini S, Sawaya BE. Monocyte chemoattractant protein-1 (MCP-1): an overview. J Interferon Cytokine Res. 2009;29(6):313-326. DOI: 10.1089/jir.2008.0027
5. Parihar A, Eubank TD, Doseff AI. Monocytes and macrophages regulate immunity through dynamic networks of survival and cell death. J Innate Immun. 2010;2(3):204-215. DOI: 10.1159/000296507
6. Passlick B, Flieger D, Ziegler-Heitbrock HW. Identification and characterization of a novel monocyte subpopulation in human peripheral blood. Blood. 1989;74(7):2527-2534.
7. Ziegler-Heitbrock L. Monocyte subsets in man and other species. Cell Immunol. 2014;289:135-139. DOI: 10.1016/j.cellimm.2014.03.019
8. Dong H, Tang X, Zhang Z, Dong C. Structural insight into lipopolysaccharide transport from the Gram-negative bacterial inner membrane to the outer membrane. Biochim Biophys Acta Mol Cell Biol Lipids. 2017;1862(11):1461-1467. DOI: 10.1016/j.bbalip.2017.08.003
9. Thomas GD, Hamers AAJ, Nakao C, Marcovecchio P, Taylor AM, McSkimming C, et al. Human Blood Monocyte Subsets: A New Gating Strategy Defined Using Cell Surface Markers Identified by Mass Cytometry. Arterioscler Thromb Vasc Biol. 2017;37(8):1548-1558. DOI: 10.1161/ATVBAHA.117.309145
10. Ziegler-Heitbrock L, Ancuta P, Crowe S, Dalod M, Grau V, Hart DN, et al. Nomenclature of monocytes and dendritic cells in blood. Blood. 2010;116(16):e74-e80. DOI: 10.1182/blood-2010-02-258558
11. Patel AA, Zhang Y, Fullerton JN, Boelen L, Rongvaux A, Maini AA, et al. The fate and lifespan of human monocyte subsets in steady state and systemic inflammation. J Exp Med. 2017;214(7):1913-1923. DOI: 10.1084/jem.20170355
12. Sugimoto C, Hasegawa A, Saito Y, Fukuyo Y, Chiu KB, Cai Y, et al. Differentiation kinetics of blood monocytes and dendritic cells in macaques: insights to understanding human myeloid cell development. J Immunol. 2015;195(4):1774-1781. DOI: 10.4049/jimmunol.1500522
13. Williams H, Mack C, Baraz R, Marimuthu R, Naralashetty S, Li S, Medbury H. Monocyte Differentiation and Heterogeneity: Inter-Subset and Interindividual Differences.Int J Mol Sci. 2023;24(10):8757. DOI: 10.3390/ijms24108757
14. Cros J, Cagnard N, Woollard K, Patey N, Zhang SY, Senechal B, et al. Human CDl4dim monocytes patrol and sense nucleic acids and viruses via TLR7 and TLR8 receptors. Immunity. 2010,33(3)375-386. DOI: 10.1016/j.immuni.2010.08.012
15. Boyette LB, Macedo C, Hadi K, Elinoff BD, Walters JT, Ramaswami B, et al. Phenotype, function, and differentiation potential of human monocyte subsets. PLoS One. 2017;12(4):e0176460. DOI: 10.1371/journal.pone.0176460
16. Tak T, Drylewicz J, Conemans L, de Boer RJ, Koenderman L, Borghans JAM, Tesselaar K. Circulatory and maturation kinetics of human monocyte subsets in vivo. Blood. 2017;130(12):1474-1477. DOI: 10.1182/blood-2017-03-771261
17. Belge KU, Dayyani F, Horelt A, Siedlar M, Frankenberger M, Frankenberger B, et al. The proinflammatory CD14+CD16+DR++ monocytes are a major source of TNF. J Immunol. 2002;168(7)3536-3542. DOI: 10.4049/jimmunol.168.7.3536
18. Wong KL, Yeap WH, Tai JJ, Ong SM, Dang TM, Wong SC. The three human monocyte subsets: implications for health and disease. Immunol Res. 2012;53(1-3):41-57. DOI: 10.1007/s12026-012-8297-3-
19. Patel AA, Ginhoux F, Yona S. Monocytes, macrophages, dendritic cells and neutrophils: an update on lifespan kinetics in health and disease. Immunology. 2021;163(3):250-261. DOI: 10.1111/imm.13320
20. Thomas G, Tacke R, Hedrick CC, Hanna RN. Nonclassical patrolling monocyte function in the vasculature. Arterioscler Thromb Vasc Biol. 2015,35(6)1306-1316. DOI: 10.1161/ATVBAHA.114.304650
21. Jakubzick CV, Randolph GJ, Henson PM. Monocyte differentiation and antigen-presenting functions. Nat Rev Immunol. 2017;17(6):349-362. DOI: 10.1038/nri.2017.28
22. Wong KL, Tai JJ, Wong WC, Han H, Sem X, Yeap WH, et al. Gene expression profiling reveals the defining features of the classical, intermediate, and nonclassical human monocyte subsets. Blood. 2011;118(5):e16-e31. 10.1182/ blood-2010-12-326355. DOI: 10.1182/blood-2010-12-326355
23. Jakubzick C, Gautier EL, Gibbings SL, Sojka DK, Schlitzer A, Johnson TE, et al. Minimal differentiation of classical monocytes as they survey steady-state tissues and transport antigen to lymph nodes. Immunity. 2013;39(3):599-610. DOI: 10.1016/j.immuni.2013.08.007
24. Ong SM, Hadadi E, Dang TM, Yeap WH, Tan CT, Ng TP, et al. The pro-inflammatory phenotype of the human nonclassical monocyte subset is attributed to senescence. Cell Death Dis. 2018;9(3):266. DOI: 10.1038/s41419-018-0327-1
25. Karsulovic C, Tempio F, Lopez M, Guerrero J, Goecke A. In vitro Phenotype Induction of Circulating Monocytes: CD16 and CD163 Analysis. J Inflamm Res. 2021;14:191-198. DOI: 10.2147/JIR.S292513-
26. Wang K, Huang H, Zhan Q, Ding H, Li Y. Toll-like receptors in health and disease. MedComm. 2024;5(5):e549. DOI: 10.1002/mco2.549
27. Hashimoto D, Chow A, Noizat C, Teo P, Beasley MB, Leboeuf M, et al. Tissue-resident macrophages self-maintain locally throughout adult life with minimal contribution from circulating monocytes. Immunity. 2013;38(4):792-804. DOI: 10.1016/j.immuni.2013.04.004
28. Susser LI, Rayner KJ. Through the layers: how macrophages drive atherosclerosis across the vessel wall. J Clin Invest. 2022;132(9):e157011. DOI: 10.1172/JCI157011
29. Hoeffel G, Ginhoux F. Fetal monocytes and the origins of tissue-resident macrophages. Cell Immunol. 2018;330:5-15. DOI: 10.1016/j.cellimm.2018.01.001
30. Strizova Z, Benesova I, Bartolini R, Novysedlak R, Cecrdlova E, Foley LK, Striz I. M1/M2 macrophages and their overlaps - myth or reality? Clin Sci (Lond). 2023;137(15):1067-1093. DOI: 10.1042/CS20220531
31. Murray PJ, Wynn TA. Protective and pathogenic functions of macrophage subsets. Nat Rev Immunol. 2011;11:723-737. DOI: 10.1038/nri2923
32. Guilliams M, Scott CL. Does niche competition determine the origin of tissue-resident macrophages? Nat Rev Immunol. 2017;17:451-460. DOI: 10.1038/nri.2017.42
33. Mildner A, Kim KW, Yona S. Unravelling monocyte functions: from the guardians of health to the regulators of disease. Discov Immunol. 2024;3(1):kyae014. DOI: 10.1093/discim/kyae014
34. Sieweke MH, Allen JE. Beyond stem cells: self-renewal of differentiated macrophages. Science. 2013;342(6161):1242974. DOI: 10.1126/science.1242974
35. Williams JW, Giannarelli C, Rahman A, Randolph GJ, Kovacic JC. Macrophage Biology, Classification, and Phenotype in Cardiovascular Disease: JACC Macrophage in CVD Series (Part 1). J Am Coll Cardiol. 2018;72(18):2166-2180. DOI: 10.1016/j.jacc.2018.08.2148
36. Barth MW, Hendrzak JA, Melnicoff MJ, Morahan PS. Review of the macrophage disappearance reaction. J Leukoc Biol. 1995;57(3):361-367. DOI: 10.1002/jlb.57.3.361
37. Guilliams M, Thierry GR, Bonnardel J, Bajenoff M. Establishment and Maintenance of the Macrophage Niche. Immunity. 2020;52(3):434-451. DOI: 10.1016/j.immuni.2020.02.015
38. Italiani P, Boraschi D. Development and Functional Differentiation of Tissue-Resident Versus Monocyte-Derived Macrophages in Inflammatory Reactions. Results Probl Cell Differ. 2017;62:23-43. DOI: 10.1007/978-3-319-54090-0_2
39. Uribe-Querol E, Rosales C. Phagocytosis: Our Current Understanding of a Universal Biological Process. Front Immunol. 2020;11:1066. DOI: 10.3389/fimmu.2020.01066
40. Hirayama D, Iida T, Nakase H. The Phagocytic Function of Macrophage-Enforcing Innate Immunity and Tissue Homeostasis.Int J Mol Sci. 2017;19(1):92. DOI: 10.3390/ijms19010092
41. Saigusa R, Winkels H, Ley K. T cell subsets and functions in atherosclerosis. Nat Rev Cardiol. 2020;17(7):387-401. DOI: 10.1038/s41569-020-0352-5
42. Sun L, Su Y, Jiao A, Wang X, Zhang B. T cells in health and disease. Signal Transduct Target Ther. 2023;8(1):235. DOI: 10.1038/s41392-023-01471-y
43. Liu T, Chen Y, Hou L, Yu Y, Ma D, Jiang T, Zhao G. Immune cell-mediated features of atherosclerosis. Front Cardiovasc Med. 2024;11:1450737. DOI: 10.3389/fcvm.2024.1450737
44. Guerriero JL. Macrophages: Their Untold Story in T Cell Activation and Function.Int Rev Cell Mol Biol. 2019;342:73-93. DOI: 10.1016/bs.ircmb.2018.07.001
45. Luckheeram RV, Zhou R, Verma AD, Xia B. CD4+T cells: dif ferentiation and functions. Clin Dev Immunol. 2012;2012:925135. DOI: 10.1155/2012/925135
46. Raphael I, Nalawade S, Eagar TN, Forsthuber TG. T cell subsets and their signature cytokines in autoimmune and inflammatory diseases. Cytokine. 2015;74(1):5-17. DOI: 10.1016/j.cyto.2014.09.011
47. Italiani P, Boraschi D. From Monocytes to M1/M2 Macrophages: Phenotypical vs. Functional Differentiation. Front Immunol. 2014;5:514. DOI: 10.3389/fimmu.2014.00514
48. Korchagina AA, Koroleva E, Tumanov AV. Innate Lymphoid Cells in Response to Intracellular Pathogens: Protection Versus Immunopathology. Front Cell Infect Microbiol. 2021;11:775554. DOI: 10.3389/fcimb.2021.775554
49. Keegan AD, Leonard WJ, Zhu J. Recent advances in understanding the role of IL-4 signaling. Fac Rev. 2021;10:71. DOI: 10.12703/r/10-71
50. Kierdorf K, Dionne MS. The Software and Hardware of Macrophages: A Diversity of Options. Dev Cell. 2016;38(2):122-125. DOI: 10.1016/j.devcel.2016.07.008
51. Unuvar Purcu D, Korkmaz A, Gunalp S, Helvaci DG, Erdal Y, Dogan Y, et al. Effect of stimulation time on the expression of human macrophage polarization markers. PLoS One. 2022;17(3):e0265196. DOI: 10.1371/journal.pone.0265196
52. Tarique AA, Logan J, Thomas E, Holt PG, Sly PD, Fantino E. Phenotypic, functional, and plasticity features of classical and alternatively activated human macrophages. Am J Respir Cell Mol Biol. 2015;53(5):676-688. DOI: 10.1165/rcmb.2015-0012OC
53. Mia S, Warnecke A, Zhang XM, Malmstru,m V, Harris RA. An optimized protocol for human M2 macrophages using M-CSF and IL-4/IL-10/TGF-ß yields a dominant immunosuppressive phenotype. Scand J Immunol. 2014;79(5):305-314. DOI: 10.1111/sji.12162
54. Maksimova AA, Shevela EYa, Sakhno LV, Tikhonova MA, Ostanin AA, Chernykh ER. M-CSF and GM-CSF determine the fibromodulating activity of polarized human macrophages. Medical Immunology. 2022;24(5):931-942. DOI: 10.15789/1563-0625-MCA-2525
55. Orekhov AN, Orekhova VA, Nikiforov NG, Myasoedova VA, Grechko AV, Romanenko EB, et al. Monocyte differentiation and macrophage polarization. Vessel Plus. 2019;3:10. DOI: 10.20517/2574-1209.2019.04
56. Ushach I, Zlotnik A. Biological role of granulocyte macrophage colony-stimulating factor (GM-CSF) and macrophage colony-stimulating factor (M-CSF) on cells of the myeloid lineage. J Leukoc Biol. 2016;100(3):481-489. DOI: 10.1189/jlb.3RU0316-144R
57. Wu J, He S, Song Z, Chen S, Lin X, Sun H, et al. Macrophage polarization states in atherosclerosis. Front Immunol. 2023;14:1185587. DOI: 10.3389/fimmu.2023.1185587
58. Turner MD, Nedjai B, Hurst T, Pennington DJ. Cytokines and chemokines: At the crossroads of cell signalling and inflammatory disease. Biochim Biophys Acta. 2014;1843(11):2563-2582. DOI: 10.1016/j.bbamcr.2014.05.014
59. Ma J, Luo J, Sun Y, Zhao Z. Cytokines associated with immune response in atherosclerosis. Am J Transl Res. 2022;14(9):6424-6444.
60. Ridker PM, Everett BM, Thuren T, MacFadyen JG, Chang WH, Ballantyne C, et al.; CANTOS Trial Group. Antiinflammatory Therapy with Canakinumab for Atherosclerotic Disease. N Engl J Med. 2017;377(12):1119-1131. DOI: 10.1056/NEJMoa1707914
61. Collins T, Read MA, Neish AS, Whitley MZ, Thanos D, Maniatis T. Transcriptional regulation of endothelial cell adhesion molecules: NF-kappa B and cytokine-inducible enhancers. FASEB J. 1995;9(10):899-909.
62. Ridker PM, Libby P, MacFadyen JG, Thuren T, Ballantyne C, Fonseca F, et al. Modulation of the interleukin-6 signalling pathway and incidence rates of atherosclerotic events and all-cause mortality: analyses from the Canakinumab AntiInflammatory Thrombosis Outcomes Study (CANTOS). Eur Heart J. 2018;39(38):3499-3507. DOI: 10.1093/eurheartj/ehy310
63. Zhou C, Gao Y, Ding P, Wu T, Ji G. The role of CXCL family members in different diseases. Cell Death Discov. 2023;9(1):212. DOI: 10.1038/s41420-023-01524-9
64. Liu Y, Hultén LM, Wiklund O. Macrophages isolated from human atherosclerotic plaques produce IL-8, and oxysterols may have a regulatory function for IL-8 production. Arterioscler Thromb Vasc Biol. 1997;17(2):317-323. DOI: 10.1161/01.atv.17.2.317
65. Rasheed A, Rayner KJ. Macrophage Responses to Environmental Stimuli During Homeostasis and Disease. Endocr Rev. 2021;42(4):407-435. DOI: 10.1210/endrev/bnab004
66. Li C, Xu MM, Wang K, Adler AJ, Vella AT, Zhou B. Macrophage polarization and meta-inflammation. Transl Res. 2018;191:29-44. DOI: 10.1016/j.trsl.2017.10.004
67. Awad F, Assrawi E, Jumeau C, Georgin-Lavialle S, Cobret L, Duquesnoy P, et al. Impact of human monocyte and macrophage polarization on NLR expression and NLRP3 inflammasome activation. PLoS One. 2017;12(4):e0175336. DOI: 10.1371/journal.pone.0175336
68. Chaintreuil P, Kerreneur E, Bourgoin M, Savy C, Favreau C, Robert G, et al. The generation, activation, and polarization of monocyte-derived macrophages in human malignancies. Front Immunol. 2023;I4:1178337. DOI: 10.3389/fimmu.2023.1178337
69. Fang F, Xiao C, Li C, Liu X, Li S. Tuning macrophages for atherosclerosis treatment. Regen Biomater. 2022;10:rbac103. DOI: 10.1093/rb/rbac103
70. Stanley AC, Lieu ZZ, Wall AA, Venturato J, Khromykh T, Hamilton NA, et al. Recycling endosome-dependent and -independent mechanisms for IL-10 secretion in LPS-activated macrophages. J Leukoc Biol. 2012;92(6):1227-1239. DOI: 10.1189/jlb.0412191
71. Lang R, Patel D, Morris JJ, Rutschman RL, Murray PJ. Shaping gene expression in activated and resting primary macrophages by IL-10. J Immunol. 2002;169(5):2253-2263. DOI: 10.4049/jimmunol.169.5.2253
72. Deng Z, Fan T, Xiao C, Tian H, Zheng Y, Li C, He J. TGF- signaling in health, disease, and therapeutics. Signal Transduct Target Ther. 2024;9(1):61. DOI: 10.1038/s41392-024-01764-w
73. Hu T, Pang N, Li Z, Xu D, Jing J, Li F, et al. The Activation of M1 Macrophages is Associated with the JNK-m6A-p38 Axis in Chronic Obstructive Pulmonary Disease.Int J Chron Obstruct Pulmon Dis. 2023;18:2195-2206. DOI: 10.2147/COPD.S420471
74. Mills CD. M1 and M2 Macrophages: Oracles of Health and Disease. Crit Rev Immunol. 2012;32(6):463-488. DOI: 10.1615/critrevimmunol.v32.i6.10
75. Xue J, Schmidt SV, Sander J, Draffehn A, Krebs W, Quester I, et al. Transcriptome-based network analysis reveals a spectrum model of human macrophage activation. Immunity. 2014;40(2):274-288. DOI: 10.1016/j.immuni.2014.01.006
76. Patente TA, Pinho MP, Oliveira AA, Evangelista GCM, Bergami-Santos PC, Barbuto JAM. Human Dendritic Cells: Their Heterogeneity and Clinical Application Potential in Cancer Immunotherapy. Front Immunol. 2019;9:3176. DOI: 10.3389/fimmu.2018.03176
77. Collin M, Bigley V. Human dendritic cell subsets: an update. Immunology. 2018;154(1):3-20. DOI: 10.1111/imm.12888
78. Segura E, Amigorena S. Inflammatory dendritic cells in mice and humans. Trends Immunol. 2013;34(9):440-445. DOI: 10.1016/j.it.2013.06.001
79. Hiasa M, Abe M, Nakano A, Oda A, Amou H, Kido S, et al. GM-CSF and IL-4 induce dendritic cell differentiation and disrupt osteoclastogenesis through M-CSF receptor shedding by up-regulation of TNF-alpha converting enzyme (TACE). Blood. 2009;114(20):4517-4526.
Выпуск
Другие статьи выпуска
В клиническом случае представлена женщина 42 лет с дефицитом липопротеинлипазы, развившимся из-за генетических вариантов в гене LPL в компаунд-гетерозиготном положении и способствующим развитию тяжелой гипертриглицеридемии (ГТГ). В данной публикации обсуждаются клинические особенности, патогенез, диагностика и лечение ГТГ, а также рассматриваются механизмы, посредством которых триглицериды (ТГ) способствуют развитию атеросклероза и острого панкреатита.
Цель. Оценить взаимосвязь между функциональной социальной поддержкой (ФСП), и липидным профилем у пациентов с атеросклеротическими ССЗ, получающих терапию ингибиторами PCSK9 (алирокумаб).
Материалы и методы. В исследование были включены 113 пациентов – 78 (69,0%) мужчин и 35 (31,0%) женщин, которым по жизненным показаниям был назначен ингибитор PCSK9 алирокумаб. Средний возраст составил 60,8±9,0 лет. Перед началом терапии проводилась оценка клинических, лабораторных и демографических показателей, а также определялся уровень ФСП посредством опросника MSPSS. Липидный профиль (общий холестерин, ЛНП, ЛВП) измерялся на исходном уровне и повторно через 6 месяцев лечения. Для анализа данных использовались статистические методы: критерии Манна–Уитни и Вилкоксона для сравнения групп, критерий χ² для качественных показателей и мультивариантная регрессия Кокса для оценки факторов, влияющих на достижение целевых уровней ЛНП.
Результаты. Обе группы пациентов (с разным уровнем ФСП) продемонстрировали значительное снижение общего холестерина и ЛНП после 6 месяцев терапии, что подтверждает высокую эффективность алирокумаба. При этом статистически значимых различий в динамике липидного профиля между группами в зависимости от уровня ФСП выявлено не было. Мультивариантный анализ показал, что исходный уровень ЛНП является единственным статистически значимым предиктором достижения целевых значений ЛНП (ОР=0,47, p <0,001), тогда как влияние ФСП оказалось статистически незначимым (ОР=0,65, p=0,25).
Заключение. Полученные данные подтверждают эффективность алирокумаба в снижении уровней ЛНП у пациентов с дислипидемией независимо от уровня ФСП. Хотя ФСП может способствовать улучшению приверженности рекомендациям по здоровому образу жизни и коррекции поведенческих факторов риска, ее прямое влияние на терапевтический ответ оказалось незначительным в рамках проведенного исследования.
Обоснование. Сердечно-сосудистые заболевания (CCЗ) атеросклеротического генеза являются ведущей причиной смертности во всем мире. Наиболее распространенным наследственным нарушением липидного обмена, характеризующимся повышением концентрации холестерина липопротеидов низкой плотности и преждевременным развитием сердечно-сосудистых заболеваний атеросклеротического генеза, является семейная гиперхолестеринемия.
Цель. Изучить биохимические и молекулярно-генетические особенности пациентов очень высокого сердечно-сосудистого риска с подозрением на семейную гиперхолестеринемию и оценить параметры чувствительности и специфичности биохимических показателей липидного профиля.
Материалы и методы. Исследование включало 50 пациентов высокого и очень высокого сердечно-сосудистого риска в возрасте от 18 до 55 лет. Всем пациентам были проведены электрофорез липидов, определение аполипопротеинов и молекулярно-генетические исследования в лаборатории диагностики аутоиммунных заболеваний при Научно-методическом центре Минздрава России по молекулярной медицине ПСПбГМУ им. академ. И. П. Павлова
Результаты. Согласно результатам NGS-секвенирования в исследуемой группе патогенные варианты в генах LDLR и АРОВ были обнаружены в 10% и 4% случаев соответственно. MLPA-анализ для определения протяженных делеций и дупликаций гена LDLR не выявил структурных изменений. Наиболее высокой прогностической ценностью обладал биохимический показатель аполипопротеин В100.
Заключение. Дальнейшее исследование молекулярно-генетических и биохимических особенностей позволит персонализировать тактику ведения пациентов с семейной гиперхолестеринемией.
Цель. Оценить отдаленные результаты лечения повторного инфаркта миокарда (ИМ) у пациентов с тромбозом/стенозом в ранее установленном стенте или с нарушением проходимости коронарной артерии вне его на фоне прогрессирования атеросклероза.
Материалы и методы. Проведен анализ 195 историй болезни пациентов, получивших лечение повторного ИМ в НИИ СП им. И. И. Джанелидзе в 2018–2021 гг. Пациенты разделены на две группы: I – люди с нарушенной проходимостью стента, установленного в предыдущую госпитализацию; II – в текущую госпитализацию визуализировано сужение коронарной артерии вне ранее установленного стента. Группы по полу и возрасту статистически не отличались. Наблюдение за пациентами осуществлялось от 24 до 26 месяцев и проводилось посредством телефонного контакта. Полученные результаты статистически обработаны с использованием параметрических и непараметрических методов статистики.
Результаты и обсуждение. В отдаленном периоде острая декомпенсированная хроническая сердечная недостаточность развивалась чаще у пациентов с нарушенной проходимостью стента. Стенокардия напряжения в обеих группах встречалась одинаково часто и приблизительно у половины пациентов. Нефатальный ИМ, нестабильная стенокардия статистически значимо чаще диагностировались в группе нарушения проходимости коронарной артерии вне стента, установленного ранее. Летальность статистически выше как общая, так и за период наблюдения, у пациентов со стенозом/тромбозом стента.
Заключение. Пациенты имеют различный постгоспитальный период течения заболевания в зависимости от инфаркт-связанного стеноза коронарной артерии (в ранее установленном стенте либо вне его).
Цель. Определить на основе программ Всемирной организации здравоохранения (ВОЗ) «Регистр острого инфаркта миокарда» (РОИМ), MONICA динамику 8-летнего (2015- 2022 гг.) применения статинов у пациентов с первичным, повторным острым инфарктом миокарда (ИМ) до развития острого случая на амбулаторном этапе, в стационаре среди лиц 25-64 лет в мегаполисе Западной Сибири (г. Новосибирск).
Материалы и методы. Все случаи ИМ в Октябрьском и Кировском районах г. Новосибирска (350 тыс. жителей) среди лиц в возрасте 25-64 лет, поступивших в стационар в 2015–2022 гг. (n=3289), были проанализированы на предмет приема статинов в условиях реальной клинической практики на амбулаторном этапе до острого случая и в стационаре с использованием международных программ ВОЗ РОИМ, MONICA. Статистический анализ проводился с помощью критерия Хи-квадрат Пирсона (точного критерия Фишера) с помощью пакета статистических программ Python. Значения р <0,05 считались статистически значимыми.
Результаты. Анализ показал, что в Новосибирске, в двух районах (Кировском и Октябрьском) число пациентов с ИМ со статинотерапией в возрасте 25–64 лет амбулаторно: до первичного случая – незначительно; до повторного случая – колеблется от 0 до 70% в период 8-летнего мониторинга. Чаще всего преобладание приема статинов было в возрастной группе 45–54 лет у мужчин и женщин за весь период наблюдения в обоих районах. Причем в возрастных группах 45–54/55–64 лет прием статинов превалирует у женщин. За исследуемый период не отмечено существенной динамики в приеме статинов на амбулаторном этапе до развития первичного ИМ; при повторном – фрагментированная динамика.
Заключение. Установили, что число пациентов со статинотерапией в возрасте 25–64 лет амбулаторно до случая первичного ИМ незначительно и не отмечено существенной динамики в приеме статинов за исследуемый период; при повторном ИМ – фрагментированная динамика. Комбинированный анализ уровней ИЛ-6 и sgp130 не только углубляет понимание воспалительного компонента патогенеза атеросклероза, но и создает основу для персонализированных стратегий профилактики и лечения.
Цель. Оценить эффективность применения ингибиторов PCSK9 – алирокумаба и инклисирана у пациентов с низкой приверженностью к статинотерапии, не достигающих целевых значений ХС ЛНП.
Материалы и методы. Проведено наблюдательное сравнительное исследование с участием 58 пациентов с исходно низкой приверженностью к статинотерапии. Пациенты распределялись в группу терапии алирокумабом (n=29) и в группу терапии инклисираном (n=29) для достижения целевых значений ХС ЛНП. Предварительно выполнено комплексное лабораторное и инструментальное обследование пациентов. Далее через 1, 3, 9 месяцев были проведены контроль уровня липидов, оценка эффективности и безопасности терапии, а также оценка приверженности пациентов терапии.
Результаты. Через 1 мес после начала терапии ингибиторами PCSK9 было отмечено сопоставимое снижение уровней ХС ЛНП в обеих группах, после 9 мес терапии было выявлено, что в группе, получающей терапию инклисираном, уровень ХС ЛНП был достоверно ниже, чем в группе больных, получающих терапию алирокумабом (1,53 ммоль/л против 2,15 ммоль соответственно, при p <0,05). Через 3 и 9 мес наблюдения приверженность к терапии снизилась в большей степени в группе алирокумаба, где чаще наблюдалось увеличение количества пропущенных инъекций и увеличение частоты случаев несвоевременного введения препаратов. Имитационная модель оценки вероятности снижения приверженности пациентов терапии в течение 15 мес наблюдения показала достоверную разницу, что несомненно отразится на прогнозе пациентов. Приверженность к терапии в группе инклисирана намного выше из-за более редкого введения препарата. Таким образом, приверженность к терапии зависела от частоты введения препарата.
Заключение. На основании проведенного исследования можно сделать вывод, что применение инклисирана как препарата с необходимостью более редкого введения позволит у пациентов с низкой приверженностью к терапии с большей вероятностью достичь целевых значений ХС ЛНП и снизить в целом риск возникновения сердечно-сосудистых осложнений.
Цель: изучить влияние фиксированной комбинации розувастатин + эзетимиб на показатели липидного профиля, включая триглицерид-богатые липопротеиды, у пациентов различных клинических групп и оценить безопасность назначения данной терапии.
Материалы и методы. В исследование включены 166 пациентов с очень высоким сердечнососудистым риском, которые получали фиксированную комбинацию розувастатина и эзетимиба (Зенон®) в различных дозировках. Пациенты были разделены на группы в зависимости от исходной гиполипидемической терапии: без терапии, умеренная монотерапия статинами и высокоинтенсивная монотерапия статинами. Также пациенты были разделены в зависимости от наличия или отсутствия ишемической болезни сердца (ИБС), сахарного диабета 2 типа (СД2), гетерозиготной семейной гиперхолестринемии (геСГХС). Оценивались показатели липидного профиля (ОХС, ХС ЛНП, ТГ, ТБЛП) до и после лечения.
Результаты. У пациентов с геСГХС уровень ОХС, ХС ЛНП, ХС неЛВП был достоверно выше, чем у больных без геСГХС. На фоне терапии фиксированной комбинацией розувастатина и эзетимиба наблюдалось значительное снижение уровня ХС ЛНП: на 64,2% – у пациентов без предшествующей терапии, на 49,2% – у пациентов с предшествующей умеренной терапией статинами и на 46,5% – у пациентов с предшествующей высокоинтенсивной терапией статинами. Целевого уровня ХС ЛНП ≤1,4 ммоль/л достигли 34% пациентов. Уровень ТБЛП снизился на 75,4%, что может способствовать снижению риска развития АССЗ. Побочные эффекты, включая повышение уровня АЛТ, наблюдались у 2,9% пациентов. Комбинированная гиполипидемическая терапия (ГЛТ) значимо снизила долю пациентов с уровнем ТБЛП >1,0 ммоль/л, что должно повлиять на уменьшение заболеваемости и смертности от АССЗ.
Заключение. Фиксированная комбинация розувастатина и эзетимиба продемонстрировала высокую эффективность и безопасность для снижения уровня ХС ЛНП и других проатерогенных липидов. Результаты подчеркивают необходимость активного внедрения комбинированной гиполипидемической терапии в клиническую практику, особенно у пациентов с сердечно-сосудистыми заболеваниями (АССЗ) и геСГХС.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- НАЦИОНАЛЬНОЕ ОБЩЕСТВО ПО ИЗУЧЕНИЮ АТЕРОСКЛЕРОЗА
- Регион
- Россия, Москва
- Почтовый адрес
- 121552, г. Москва, ул. Академика Чазова, дом 15А
- Юр. адрес
- 115088, г Москва, Южнопортовый р-н, ул 2-я Машиностроения, д 17 стр 1, помещ I офис 52, ком 63
- ФИО
- Сергиенко Игорь Владимирович (ДИРЕКТОР)
- E-mail адрес
- igorcardio@mail.ru
- Контактный телефон
- +7 (495) 4147286
- Сайт
- https://noatero.ru/