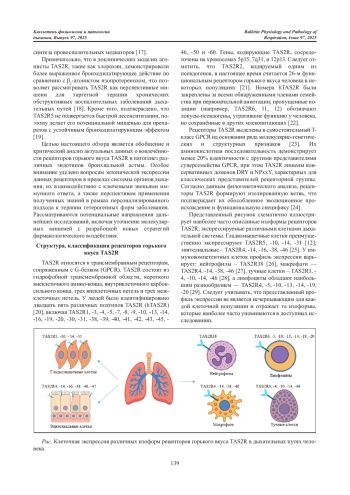
В обзоре обобщены современные данные о роли эктопических рецепторов горького вкуса (TAS2R) в патогенезе бронхиальной астмы (БА) в контексте персонализированного подхода к терапии. TAS2R, экспрессируемые в эпителии дыхательных путей, гладкой мускулатуре и иммунокомпетентных клетках, участвуют в ключевых звеньях воспалительного процесса и регуляции бронхиального тонуса. Активация TAS2R приводит к релаксации гладкой мускулатуры дыхательных путей через сигнальные каскады, независимые от β2-адренорецепторов и цАМФ, что обеспечивает эффективность в условиях сниженной чувствительности к β2-агонистам. В Т2- высоком эндотипе БА TAS2R подавляют интерлейкины (ИЛ)-4, ИЛ-5, ИЛ-13, снижая эозинофильное воспаление и дегрануляцию тучных клеток. В не-Т2-вариантах БА рецепторы ингибируют провоспалительные медиаторы (ИЛ-17, ИЛ-8, фактора некроза опухоли α), уменьшают активность нейтрофилов и макрофагов. TAS2R рассматриваются как перспективные фармакологические мишени, особенно в трудно контролируемых формах астмы, резистентных к ингаляционным глюкокортикостероидам. В научной литературе упоминаются исследования препаратов, которые обладают агонистической активностью в отношении TAS2R, и ведутся поиски эндогенных агонистов рецепторов. Представленный материал подчёркивает необходимость дальнейших исследований, направленных на уточнение молекулярных механизмов действия TAS2R, перспективы применения TAS2R-ориентированной терапии при различных эндотипах БА, оценку клинической эффективности и безопасности терапевтических агентов, направленных на персонализацию лечения БА на основе изучения генетических и функциональных особенностей этих рецепторов.
Идентификаторы и классификаторы
- SCI
- Здравоохранение
Бронхиальная астма (БА) представляет собой одно из наиболее распространённых хронических воспалительных заболеваний дыхательных путей, встречающееся в различных возрастных группах, включая как детское, так и взрослое население. На сегодняшний день БА рассматривается как гетерогенное заболевание, характеризующееся разнообразием клинических фенотипов и патофизиологических механизмов [1]. Пусковыми факторами его обострения, как правило, выступают различные внешние и внутренние триггеры, включая воздействие аллергенов, психоэмоциональный стресс, физическую нагрузку, а также влияние загрязняющих веществ природного, техногенного и бытового происхождения [2]. Указанные триггеры индуцируют каскад воспалительных реакций, степень выраженности и характер которых определяются индивидуальной предрасположенностью пациента и типом иммунного ответа.
Список литературы
1. Global initiative for asthma (GINA). Global strategy for asthma management and prevention. (Update 2025). URL: https://ginasthma.org/2025-gina-main-report.
2. Byrwa-Hill B.M., Morphew T.L., Presto A.A., Fabisiak J.P., Wenzel S.E. Living in environmental justice areas worsens asthma severity and control: differential interactions with disease duration, age at onset, and pollution // J. Allergy Clin. Immunol. 2023. Vol.152, Iss.5. P.1321-1329.e5. DOI: 10.1016/j.jaci.2023.04.015
3. Перельман Ю.М., Перельман Н.Л., Колосов В.П. Качество жизни больных бронхиальной астмой. Владивосток: Дальнаука, 2024. 252 с. ISBN: 978-5-8044-1738-4
4. Федосеев Г.Б. Современное представление о причинах возникновения, особенностях течения и лечения бронхиальной астмы. Актовая речь. Л.: “1ЛМИ им. акад. И.П. Павлова”, 1982. С.28.
5. Lai K., Zhan W., Wu F., Zhang Y., Lin L., Li W., Yi F., Jiang Z., Dai Y., Li S., Lin J., Yuan Y., Jiang Y., Qiu C., Zhao L., Chen M., Qiu Z., Li H., Chen R., Luo W., Xie J., Guo C., Jiang M., Yang X., Shi G., Sun D., Chen R., Chung K.F., Shen H., Zhong N. Clinical and inflammatory characteristics of the Chinese APAC cough variant asthma cohort // Front. Med. (Lausanne). 2022. Vol.8. Article number:807385. DOI: 10.3389/fmed.2021.807385
6. Ибишева А.Х., Шахгиреева М.Р., Хильдихароева А.Б., Успанова Л.С., Шамсадова С.А., Джабраилова Л.В. Бронхиальная астма в эпоху персонализированной медицины // Сибирский научный медицинский журнал. 2024. Т.44, №6. С.41-47. DOI: 10.18699/SSMJ20240604
7. Файзуллина Р.М., Викторов В.В., Гафурова Р.Р. Персонализированная медицина бронхиальной астмы: концепция и перспективы // Вестник Авиценны. 2021. Т.23, №3. С.418-431. DOI: 10.25005/2074-0581-2021-23-3-418-431
8. Ray A., Das J., Wenzel S.E. Determining asthma endotypes and outcomes: complementing existing clinical practice with modern machine learning // Cell Rep. Med. 2022. Vol.3, Iss.12. Article number:100857. DOI: 10.1016/j.xcrm.2022.100857
9. Авдеев С.Н., Волкова О.А., Демко И.В., Игнатова Г.Л., Лещенко И.В., Канукова Н.А., Куделя Л.М., Невзорова В.А., Недашковская Н.Г., Уханова О.П., Шульженко Л.В., Фассахов Р.С. Организация помощи пациентам с тяжёлой бронхиальной астмой в различных субъектах Российской Федерации. От эндотипов и фенотипов бронхиальной астмы к персонализированному выбору терапии // Терапевтический архив. 2020. Т.92, №2. С.119-123. DOI: 10.26442/00403660.2020.02.000555
10. Bourdin A., Brusselle G., Couillard S., Fajt M.L., Heaney L.G., Israel E., McDowell P.J., Menzies-Gow A., Martin N., Mitchell P.D., Petousi N., Quirce S., Schleich F., Pavord I.D. Phenotyping of severe asthma in the era of broad-acting anti-asthma biologics // J. Allergy Clin. Immunol. Pract. 2024. Vol.12, Iss.4. P.809-823. DOI: 10.1016/j.jaip.2024.01.023
11. Chung K.F., Dixey P., Abubakar-Waziri H., Bhavsar P., Patel P.H., Guo S., Ji Y. Characteristics, phenotypes, mechanisms and management of severe asthma // Chin. Med. J. 2022. Vol.135, Iss.10. P.1141-1155. DOI: 10.1097/CM9.0000000000001990
12. Deshpande D.A., Wang W.C., McIlmoyle E.L., Robinett K.S., Schillinger R.M., An S.S., Sham J.S.K., Liggett S.B. Bitter taste receptors on airway smooth muscle bronchodilate by localized calcium signaling and reverse obstruction // Nat. Med. 2010. Vol.16, Iss.11. P.1299-1304. DOI: 10.1038/nm.2237
13. Harmon C.P., Deng D., Breslin P.A.S. Bitter taste receptors (T2Rs) are sentinels that coordinate metabolic and immunological defense responses // Curr. Opin. Physiol. 2021. Vol.20. P.70-76. DOI: 10.1016/j.cophys.2021.01.006
14. Lee R.J., Cohen N.A. Bitter and sweet taste receptors in the respiratory epithelium in health and disease // J. Mol. Med. (Berl.). 2014. Vol. 92, Iss.12. P.1235-1244. DOI: 10.1007/s00109-014-1222-6
15. Grassin-Delyle S., Abrial C., Fayad-Kobeissi S., Brollo M., Faisy C., Alvarez J.C., Naline E., Devillier P. The expression and relaxant effect of bitter taste receptors in human bronchi // Respir. Res. 2013. Vol.14, Iss.1. Article number:134. DOI: 10.1186/1465-9921-14-134
16. Carey R.M., Lee R.J. Taste receptors in upper airway innate immunity // Nutrients. 2019. Vol.11, Iss.9. Article number:2017. DOI: 10.3390/nu11092017
17. Martens K., Steelant B., Bullens D.M.A. Taste receptors: the gatekeepers of the airway epithelium // Cells. 2021. Vol.10, Iss.11. Article number:2889. DOI: 10.3390/cells10112889
18. Liggett S.B. Bitter taste receptors on airway smooth muscle as targets for novel bronchodilators // Expert Opin. Ther. Targets. 2013. Vol.17, Iss.6. P.721-731. DOI: 10.1517/14728222.2013.782395
19. Kim D., Strzelinski H.R., Liggett S.B. TAS2R5 screening reveals biased agonism that fails to evoke internalization and downregulation resulting in attenuated desensitization // PLoS One. 2025. Vol.20, Iss.2. Article number:e0315820. DOI: 10.1371/journal.pone.0315820
20. Tuzim K., Korolczuk A. An update on extra-oral bitter taste receptors // J. Transl. Med. 2021. Vol.19, Iss.1. Article number:440. DOI: 10.1186/s12967-021-03067-y
21. Lang T., Di Pizio A., Risso D., Drayna D., Behrens M. Activation profile of TAS2R2, the 26th human bitter taste receptor // Mol. Nutr. Food Res. 2023. Vol.67, Iss.11. Article number:2200775. DOI: 10.1002/mnfr.202200775
22. Risso D., Behrens M., Sainz E., Meyerhof W., Drayna D. Probing the evolutionary history of human bitter taste receptor pseudogenes by restoring their function // Mol. Biol. Evol. 2017. Vol.34, Iss.7. P.587-1595. DOI: 10.1093/molbev/msx097
23. Zhang M., Chen T., Lu X., Lan X., Chen Z., Lu S. G protein-coupled receptors (GPCRs): advances in structures, mechanisms and drug discovery // Signal Transduct. Target. Ther. 2024. Vol.9, Iss.1. Article number:88. DOI: 10.1038/s41392-024-01803-6
24. Cannariato M., Fanunza R., Zizzi E.A., Miceli M., Di Benedetto G., Deriu M.A., Pallante L. Exploring TAS2R46 biomechanics through molecular dynamics and network analysis // Front. Mol. Biosci. 2024. Vol.11. Article number:1473675. DOI: 10.3389/fmolb.2024.1473675
25. Woo J.A., Castaño M., Kee T.R., Lee J., Koziol-White C.J., An S.S., Kim D., Kang D.E., Liggett S.B. A Par3/LIM kinase/cofilin pathway mediates human airway smooth muscle relaxation by TAS2R14 // Am. J. Respir. Cell Mol. Biol. 2023. Vol.68, Iss.4. P.417-429. DOI: 10.1165/rcmb.2022-0303OC
26. Nayak A.P., Shah S.D., Michael J.V., Deshpande D.A. Bitter taste receptors for asthma therapeutics // Front. Physiol. 2019. Vol.10. Article number:884. DOI: 10.3389/fphys.2019.00884
27. Gaida M.M., Dapunt U., Hänsch G.M. Sensing developing biofilms: the bitter receptor T2R38 on myeloid cells // Pathog. Dis. 2016. Vol.74, Iss.3. Article number:ftw004. DOI: 10.1093/femspd/ftw004
28. Meyerhof W., Batram C., Kuhn C., Brockhoff A., Chudoba E., Bufe B., Appendino G., Behrens M. The molecular receptive ranges of human TAS2R bitter taste receptors // Chem. Senses. 2010. Vol.35, Iss.2. P.157-170. DOI: 10.1093/chemse/bjp092
29. Grassin-Delyle S., Salvator H., Mantov N., Abrial C., Brollo M., Faisy C., Naline E., Couderc L.J., Devillier P. Bitter taste receptors (TAS2Rs) in human lung macrophages: receptor expression and inhibitory effects of TAS2R agonists // Front. Physiol. 2019. Vol.10. Article number:1267. DOI: 10.3389/fphys.2019.01267
30. Behrens M. The growing complexity of human bitter taste perception // J. Agric. Food Chem. 2024. Vol.72, Iss.26. P.14530-14534. DOI: 10.1021/acs.jafc.4c02465
31. Roelse M., Krasteva N., Pawlizak S., Mai M.K., Jongsma M.A. Tongue-on-a-chip: parallel recording of sweet and bitter receptor responses to sequential injections of pure and mixed sweeteners // J. Agric. Food Chem. 2024. Vol.72, Iss.28. P.15854-15864. DOI: 10.1021/acs.jafc.4c00815
32. Talmon M., Pollastro F., Fresu L.G. The complex journey of the calcium regulation downstream of TAS2R activation // Cells. 2022. Vol.11, Iss.22. Article number:3638. DOI: 10.3390/cells11223638
33. Richter P., Andersen G., Kahlenberg K., Mueller A.U., Pirkwieser P., Boger V., Somoza V. Sodium-permeable ion channels TRPM4 and TRPM5 are functional in human gastric parietal cells in culture and modulate the cellular response to bitter-tasting food constituents // J. Agric. Food Chem. 2024. Vol.72, Iss.9. P.4906-4917. DOI: 10.1021/acs.jafc.3c09085
34. Yuan G., Jing Y., Wang T., Fernandes V.S., Xin W. The bitter taste receptor agonist-induced negative chronotropic effects on the Langendorff-perfused isolated rat hearts // Eur. J. Pharmacol. 2020. Vol.876. Article number:173063. DOI: 10.1016/j.ejphar.2020.173063
35. Kim D., Cho S., Castaño M.A., Panettieri R.A., Woo J.A., Liggett S.B. Biased TAS2R bronchodilators inhibit airway smooth muscle growth by downregulating phosphorylated extracellular signal-regulated kinase 1/2 // Am. J. Respir. Cell Mol. Biol. 2019. Vol.60, Iss.5. P.532-540. DOI: 10.1165/rcmb.2018-0189OC
36. Gopallawa I., Freund J.R., Lee R.J. Bitter taste receptors stimulate phagocytosis in human macrophages through calcium, nitric oxide, and cyclic-GMP signaling // Cell. Mol. Life Sci. 2021. Vol.78, Iss.1. P.271-286. DOI: 10.1007/s00018-020-03494-y
37. Agarwal S.L., Deshmankar B.S., Bhargava V. Chloroquine in bronchial asthma // J. Pharm. Pharmacol. 1963. Vol.15, Iss.10. P.693-696. DOI: 10.1111/j.2042-7158.1963.tb12862.x
38. Malki A., Fiedler J., Fricke K., Ballweg I., Pfaffl M.W., Krautwurst D. Class I odorant receptors, TAS1R and TAS2R taste receptors, are markers for subpopulations of circulating leukocytes // J. Leukoc. Biol. 2015. Vol.97, Iss.3. P.533-545. DOI: 10.1189/jlb.2A0714-331RR
39. Kook J.H., Kim H.K., Kim H.J., Kim K.W., Kim T.H., Kang K.R., Oh D.J., Lee S.H. Increased expression of bitter taste receptors in human allergic nasal mucosa and their contribution to the shrinkage of human nasal mucosa // Clin. Exp. Allergy. 2016. Vol.46, Iss.4. P.584-601. DOI: 10.1111/cea.12727
40. Orsmark-Pietras C., James A., Konradsen J.R., Nordlund B., Söderhäll C., Pulkkinen V., Pedroletti C., Daham K., Kupczyk M., Dahlén B., Kere J., Dahlén S.E., Hedlin G., Melén E. Transcriptome analysis reveals upregulation of bitter taste receptors in severe asthmatics // Eur. Respir. J. 2013. Vol.42, Iss.1. P.65-78. DOI: 10.1183/09031936.00077712
41. Ni K., Guo J., Bu B., Pan Y., Li J., Liu L., Luo M., Deng L. Naringin as a plant-derived bitter tastant promotes proliferation of cultured human airway epithelial cells via activation of TAS2R signaling // Phytomedicine. 2021. Vol.84. Article number:153491. DOI: 10.1016/j.phymed.2021.153491
42. McMahon D.B., Kuek L.E., Johnson M.E., Johnson P.O., Horn R.L.J., Carey R.M., Adappa N.D., Palmer J.N., Lee R.J. The bitter end: T2R bitter receptor agonists elevate nuclear calcium and induce apoptosis in non-ciliated airway epithelial cells // Cell Calcium. 2022. Vol.101. Article number:102499. DOI: 10.1016/j.ceca.2021.102499
43. Sharma P., Yi R., Nayak A.P., Wang N., Tang F., Knight M.J., Pan S., Oliver B., Deshpande D.A. Bitter taste receptor agonists mitigate features of allergic asthma in mice // Sci. Rep. 2017. Vol.7. Article number:46166. DOI: 10.1038/srep46166
44. Izuhara K., Arima K., Yasunaga S. IL-4 and IL-13: their pathological roles in allergic diseases and their potential in developing new therapies // Curr. Drug Targets Inflamm. Allergy. 2002. Vol.1, Iss.3. P.263-269. DOI: 10.2174/1568010023344661
45. Makita K., Mikami Y., Matsuzaki H., Miyashita N., Takeshima H., Noguchi S., Horie M., Urushiyama H., Iikura M., Hojo M., Nagase T., Yamauchi Y. Mechanism of periostin production in human bronchial smooth muscle cells // Int. Arch. Allergy Immunol. 2018. Vol.175, Iss.1-2. P.26-35. DOI: 10.1159/000485892
46. Ekoff M., Choi J.H., James A., Dahlén B., Nilsson G., Dahlén S.E. Bitter taste receptor (TAS2R) agonists inhibit IgE-dependent mast cell activation // J. Allergy Clin. Immunol. 2014. Vol.134, Iss.2. P.475-478. DOI: 10.1016/j.jaci.2014.02.029
47. Наумов Д.Е., Гассан Д.А., Котова О.О., Шелудько Е.Г., Афанасьева Е.Ю., Конев А.В., Перельман Ю.М. Эффект полиморфизмов гена TAS2R20 на формирование бронхиальной астмы и течение заболевания // Бюллетень физиологии и патологии дыхания. 2024. Вып.94. С.40-50. DOI: 10.36604/1998-5029-2024-94-40-50
48. Крапошина А.Ю., Собко Е.А., Демко И.В., Кацер А.Б., Казмерчук О.В., Абрамов Ю.И. Современное представление о бронхиальной астме с фиксированной обструкцией // Терапевтический архив. 2021. Т.93, №3. С.337-342. DOI: 10.26442/00403660.2021.03.200661
49. Habib N., Pasha M.A., Tang D.D. Current understanding of asthma pathogenesis and biomarkers // Cells. 2022. Vol.11, Iss.17. Article number:2764. DOI: 10.3390/cells11172764
50. Jalševac F., Segú H., Balaguer F., Ocaña T., Moreira R., Abad-Jordà L., Gràcia-Sancho J., Fernández-Iglesias A., Andres-Lacueva C., Martínez-Huélamo M., Beltran-Debon R., Rodríguez-Gallego E., Terra X., Ardévol A., Pinent M. TAS2R5 and TAS2R38 are bitter taste receptors whose colonic expressions could play important roles in age-associated processes // J. Nutr. Biochem. 2025. Vol.140. Article number:109872. DOI: 10.1016/j.jnutbio.2025.109872
51. Yang M., Kumar R.K., Hansbro P.M., Foster P.S. Emerging roles of pulmonary macrophages in driving the development of severe asthma // J. Leukoc. Biol. 2012. Vol.91, Iss.4. P.557-569. DOI: 10.1189/jlb.0711357
52. Wölfle U., Haarhaus B., Schempp C.M. Amarogentin displays immunomodulatory effects in human mast cells and keratinocytes // Mediators Inflamm. 2015. Vol.2015. Article number:630128. DOI: 10.1155/2015/630128
53. Tran H.T.T., Herz C., Ruf P., Stetter R., Lamy E. Human T2R38 bitter taste receptor expression in resting and activated lymphocytes // Front. Immunol. 2018. Vol.9. Article number:2949. DOI: 10.3389/fimmu.2018.02949
54. Maurer S., Wabnitz G.H., Kahle N.A., Stegmaier S., Prior B., Giese T., Gaida M.M., Samstag Y., Hänsch G.M. Tasting Pseudomonas aeruginosa biofilms: human neutrophils express the bitter receptor T2R38 as sensor for the quorum sensing molecule N-(3-oxododecanoyl)-L-homoserine lactone // Front. Immunol. 2015. Vol.6. Article number:369. DOI: 10.3389/fimmu.2015.00369
55. Vidaillac C., Chotirmall S.H. Pseudomonas aeruginosa in bronchiectasis: infection, inflammation, and therapies // Expert Rev. Respir. Med. 2021. Vol.15, Iss.5. P.649-662. DOI: 10.1080/17476348.2021.1906225
56. Lee R.J., Kofonow J.M., Rosen P.L., Siebert A.P., Chen B., Doghramji L., Xiong G., Adappa N.D., Palmer J.N., Kennedy D.W., Kreindler J.L., Margolskee R.F., Cohen N.A. Bitter and sweet taste receptors regulate human upper respiratory innate immunity // J. Clin. Invest. 2014. Vol.124, Iss.3. P.1393-1405. DOI: 10.1172/JCI72094
57. Kobayashi D., Watarai T., Ozawa M., Kanda Y., Saika F., Kiguchi N., Takeuchi A., Ikawa M., Matsuzaki S., Katakai T. Tas2R signaling enhances mouse neutrophil migration via a ROCK-dependent pathway // Front. Immunol. 2022. Vol. 13. Article number:973880. DOI: 10.3389/fimmu.2022.973880
58. Aoki M., Takao T., Takao K., Koike F., Suganuma N. Lower expressions of the human bitter taste receptor TAS2R in smokers: reverse transcriptase-polymerase chain reaction analysis // Tob. Induc. Dis. 2014. Vol.12. Article number:12. DOI: 10.1186/1617-9625-12-12
59. Tran H.T.T., Stetter R., Herz C., Spöttel J., Krell M., Hanschen F.S., Schreiner M., Rohn S., Behrens M., Lamy E. Allyl isothiocyanate: a TAS2R38 receptor-dependent immune modulator at the interface between personalized medicine and nutrition // Front. Immunol. 2021. Vol.12. Article number:669005. DOI: 10.3389/fimmu.2021.669005
60. Jeruzal-Świątecka J., Borkowska E.M., Borkowska M., Pietruszewska W. TAS2R38 bitter taste receptor polymorphisms in patients with chronic rhinosinusitis with nasal polyps: preliminary data in Polish population // Biomedicines. 2024. Vol.12, Iss.1. Article number:168. DOI: 10.3390/biomedicines12010168
61. Calancie L., Keyserling T.C., Smith Taillie L., Robasky K., Patterson C., Ammerman A.S., Schisler J.C. TAS2R38 predisposition to bitter taste associated with differential changes in vegetable intake in response to a community-based dietary intervention // G3 (Bethesda). 2018. Vol.8, Iss.6. P.2107-2119. DOI: 10.1534/g3.118.300547
62. Shore S.A. Obesity, airway hyperresponsiveness, and inflammation // J. Appl. Physiol. 2010. Vol.108, Iss.3. P.735-743. DOI: 10.1152/japplphysiol.00749.2009
63. Cancello R., Micheletto G., Meta D., Lavagno R., Bevilacqua E., Panizzo V., Invitti C. Expanding the role of bitter taste receptor in extra oral tissues: TAS2R38 is expressed in human adipocytes // Adipocyte. 2020. Vol.9, Iss.1. P.7-15. DOI: 10.1080/21623945.2019.1709253
64. Liszt K.I., Wang Q., Farhadipour M., Segers A., Thijs T., Nys L., Deleus E., Tack J., Depoortere I. Human intestinal bitter taste receptors regulate innate immune responses and metabolic regulators in obesity // J. Clin. Invest. 2022. Vol.132, Iss.3. Article number:e144828. DOI: 10.1172/JCI144828
65. Foschino Barbaro M.P., Costa V.R., Resta O., Prato R., Spanevello A., Palladino G.P., Martinelli D., Carpagnano G.E. Menopausal asthma: a new biological phenotype? // Allergy. 2010. Vol.65, Iss.10. P.1306-1312. DOI: 10.1111/j.1398-9995.2009.02314.x
66. Trivedi S., Deering-Rice C.E., Aamodt S.E., Huecksteadt T.P., Myers E.J., Sanders K.A., Paine R. III, Warren K.J. Progesterone amplifies allergic inflammation and airway pathology in association with higher lung ILC2 responses // Am. J. Physiol. Lung Cell. Mol. Physiol. 2024. Vol.327, Iss.1. P.L65-L78. DOI: 10.1152/ajplung.00207.2023
67. Yung J.A., Fuseini H., Newcomb D.C. Hormones, sex, and asthma // Ann. Allergy Asthma Immunol. 2018. Vol.120, Iss.5. P.488-494. DOI: 10.1016/j.anai.2018.01.016
68. Lossow K., Hübner S., Roudnitzky N., Slack J.P., Pollastro F., Behrens M., Meyerhof W. Comprehensive analysis of mouse bitter taste receptors reveals different molecular receptive ranges for orthologous receptors in mice and humans // J. Biol. Chem. 2016. Vol.291, Iss.29. P.15358-15377. DOI: 10.1074/jbc.M116.718544
69. Ziegler F., Steuer A., Di Pizio A., Behrens M. Physiological activation of human and mouse bitter taste receptors by bile acids // Commun. Biol. 2023. Vol.6, Iss.1. Article number:612. DOI: 10.1038/s42003-023-04971-3
70. Jiang J., Liu S., Qi L., Wei Q., Shi F. Activation of ovarian taste receptors inhibits progesterone production potentially via NO/cGMP and apoptotic signaling // Endocrinology. 2021. Vol.162, Iss.3. Article number:bqaa240. DOI: 10.1210/endocr/bqaa240
71. Ni K., Che B., Gu R., Wang C., Xu H., Li H., Cen S., Lu o M., Deng L. BitterDB database analysis plus cell stiffness screening identify flufenamic acid as the most potent TAS2R14-based relaxant of airway smooth muscle cells for therapeutic bronchodilation. // Theranostics. 2024. Vol.14, Iss.4 P.1744-1763. DOI: 10.7150/thno.92492
72. Sun S., Yang Y., Xiong R., Ni Y., Ma X., Hou M., Chen L., Xu Z., Chen L, Ji M. Oral berberine ameliorates high-fat diet-induced obesity by activating TAS2Rs in tuft and endocrine cells in the gut // Life Sci. 2022. Vol.311, Pt A. Article number:121141. DOI: 10.1016/j.lfs.2022.121141
73. Medapati M.R., Singh N., Bhagirath A.Y., Duan K., Triggs-Raine B., Batista E.L. Jr., Chelikani P. Bitter taste receptor T2R14 detects quorum-sensing molecules from cariogenic Streptococcus mutans and mediates innate immune responses in gingival epithelial cells // FASEB J. 2021. Vol.35, Iss.3. Article number:e21375. DOI: 10.1096/fj.202000208R
74. Miller Z.A., Mueller A., Kim T.B., Jolivert J.F., Ma R.Z., Muthuswami S., Park A., McMahon D.B., Nead K.T., Carey R.M., Lee R.J. Lidocaine induces apoptosis in head and neck squamous cell carcinoma through activation of bitter taste receptor T2R14 // Cell Rep. 2023. Vol.42, Iss.12. Article number:113437. DOI: 10.1016/j.celrep.2023.113437
75. Waterloo L., Hübner H., Fierro F., Pfeiffer T., Brox R., Löber S., Weikert D., Niv M.Y., Gmeiner P. Discovery of 2-aminopyrimidines as potent agonists for the bitter taste receptor TAS2R14 // J. Med. Chem. 2023. Vol.66, Iss.5. P.3499-3521. DOI: 10.1021/acs.jmedchem.2c01997
76. Rajagopal S., Shenoy S.K. GPCR desensitization: acute and prolonged phases // Cell. Signal. 2018. Vol.41. P.9-16. http s://.
Выпуск
Другие статьи выпуска
Acinetobacter baumannii – один из самых часто инфекционных агентов, выявляемых во всем мире, важными особенностями которых являются высокая частота мутаций, приводящая к быстрому развитию антибиотикорезистентности, и устойчивость к дезинфекции. В данном обзоре представлены сведения о значимости этого патогена в инфекционной патологии, механизмах, лежащих в основе заболеваний, связанных с A. baumannii, факторах вирулентности, множественной лекарственной устойчивости возбудителя, его резистентности к агрессивным факторам внешней среды, приёмах, используемых патогеном для колонизации и заражения организма человека, факторах риска развития инфекции, клинических формах вызываемых им заболеваний. Обсужден выбор препаратов для терапии инфекций, обусловленных A. baumannii. Проведен поиск и анализ отечественных и зарубежных научных публикаций с использованием поисковых систем электронных библиотек – eLIBRARY. ru, PubMed, Google Scholar, КиберЛенинка.
Высокая распространенность герпесвирусной инфекции среди женщин репродуктивного возраста и возможностью латентного течения с последующей реактивацией диктует важность изучения морфологических изменений плаценты, возникающих при инфицировании вирусами простого герпеса (ВПГ) 1 и 2 типов. Статья посвящена морфологической характеристике изменений плаценты при герпесвирусной инфекции и ее связи с развитием перинатальной патологии у плода. Описаны микроскопические признаки, позволяющие заподозрить герпетическое поражение плаценты: хронический виллит, интервиллузит, васкулит, очаговый некроз ворсин, деструкция трофобласта, поражение клеток Кащенко-Гофбауэра и образование гигантских многоядерных клеток с вирусными включениями (ВПГ-клетки Каудри типа В). Проанализированы отличия между ВПГ-1 и ВПГ-2 в зависимости от степени выраженности воспалительно-деструктивных, сосудистых изменений, а также клинических последствий внутриутробного инфицирования. Отмечена большая нейротропность и склонность к генерализации инфекции ВПГ-2 в сравнении с ВПГ-1. В процессе подготовки использовались публикации, размещенные в международных и российских научных базах данных, включая PubMed, eLibrary и Google Scholar. Для поиска использовались ключевые слова: герпетический плацентит, интервиллузит, фунникулит, placental pathomorphology, fetoplacental insufficiency, связь с перинатальной патологией и их сочетания на русском и английском языках.
Введение. Первичная цилиарная дискинезия (ПЦД) – редкое наследственное заболевание из группы цилиопатий, характеризующееся поражением всех отделов респираторного тракта с формированием хронического воспалительного процесса и бронхоэктазов. Цель. Описать наблюдение пациента с ПЦД для ознакомления врачей с клиническими особенностями заболевания и современными возможностями диагностики. Материалы и методы. Приведено описание клинического случая выявления ПЦД у ребенка, наблюдавшегося в Хабаровском филиале ДНЦ ФПД – НИИ ОМиД. Результаты. На основании анамнестических (пульмонологический анамнез с шести месяцев, неоднократные затяжные бронхиты, пневмонии), клинических (частые риниты, отиты, влажный кашель), инструментальных (спиральная компьютерная томография, бронхоскопия) данных у ребенка был заподозрен диагноз ПЦД. При проведении высокоскоростной видеомикроскопии было выявлено значительное снижение функции цилиарного эпителия за счет сокращения процента клеток с подвижными ресничками, уменьшения частоты движения ресничек, измененного характера их биения. При полногеномном исследовании обнаружили компауд-гетерозиготу в гене DNAH9, ассоциированную с заболеванием: первичная цилиарная дискинезия, тип 40. Пациенту был установлен диагноз: врожденный порок развития бронхов: первичная цилиарная дискинезия Q32.4. Заключение. Продемонстрированы трудности и возможности диагностики ПЦД, способствующие назначению адекватной систематической терапии – ключевого условия оптимистического прогноза у детей с данной нозологией.
Введение. Оказание необходимой помощи паллиативным пациентам и их близким является одной из актуальных задач российского здравоохранения с учетом размера этой группы – количество неизлечимых больных, потенциально нуждающихся в паллиативном уходе, составляло в РФ в 2023 г. не менее 1,7 млн чел. Онкологические заболевания касаются 60–80% пациентов в паллиативе, в том числе это – онкология органов дыхания. Дефицит кадрового обеспечения паллиативных служб может быть частично устранен за счет привлечения волонтеров. При этом сам институт паллиативной помощи еще находится в процессе становления и важно фиксировать мотивы добровольцев для повышения качества оказываемой помощи, управления этим процессом. Цель – анализ социального портрета волонтера паллиативной медицинской помощи в Свердловской области. Материалы и методы. Исследование проведено в 2024 г.; опрошено 107 студентов Свердловского областного медицинского колледжа. Результаты. В волонтерское движение вовлечены в подавляющем большинстве студентки специальностей «Сестринское дело» и «Лечебное дело». По самооценкам респондентов, волонтерство обеспечивает развитие коммуникативных навыков, способностей к общению и пониманию собеседников, критичному восприятию профессиональных ошибок, а также повышает успеваемость в практическом обучении. Наибольшее влияние на вовлеченность в волонтерскую деятельность оказывают возможности обретения нового опыта, профессиональных знаний, умений и навыков, понимание пользы, доставляемой волонтерами больному человеку. Выделены противоречия в восприятии паллиативного волонтерства: несоответствие между развитием коммуникативных навыков и профессиональных умений волонтеров и отсутствием значимых личностных перемен в их жизни; противоречие между осознанием своей полезности и приобретением нового опыта, с одной стороны, и слабой экстраполяцией этого опыта на повышение самооценки и способности решать личные эмоциональные проблемы, с другой; несоответствие между гендерными стереотипами в обществе (уход как «женская» работа) и потребностью в привлечении волонтеров обоих полов для оказания паллиативной помощи. Заключение. Социальный портрет студента-волонтера паллиативной помощи отражает сочетание профессиональной ориентации и ценностно-эмоциональных мотивов. Несмотря на сложности, участие в волонтерской деятельности способствует формированию компетенций, востребованных в медицине, и укрепляет социальную ответственность молодежи. Для развития этой практики критически важны системная поддержка со стороны образовательных учреждений, медицинских и общественных организаций. Полученные данные дают представление о противоречиях и перспективах развития данного отряда волонтерского движения в ключе разработки соответствующих образовательных программ.
Введение. Обострение бронхиальной астмы легкой степени тяжести, обусловленное реактивацией вирусной инфекции у женщин в период беременности, часто сопровождается развитием у их потомства церебральной и кардиальной патологии. Учитывая негативное влияние перинатального поражения головного мозга на электрическую стабильность миокарда, возрастает значимость изучения функционального состояния сердца при церебральной ишемии различной степени тяжести у новорожденных, матери которых перенесли обострение бронхиальной астмы на фоне острой фазы хронической цитомегаловирусной (ЦМВ) инфекции во втором триместре гестации. Цель. Оценить состояние сердечно-сосудистой системы при церебральной ишемии у новорожденных от матерей с обострением бронхиальной астмы легкой степени тяжести, ассоциированной с реактивацией хронической ЦМВ инфекции в период беременности. Материалы и методы. Оценивали состояние по шкале Апгар, параметры электрокардиографического исследования у 41 новорожденного от матерей с неосложненным течением беременности (контрольная группа) и у 61 новорожденного с церебральной ишемией и антенатальным анамнезом, отягощенным обострением бронхиальной астмы легкой степени тяжести, обусловленным реактивацией хронической ЦМВ инфекции у их матерей во втором триместре гестации (основная группа). В первую подгруппу основной группы входили 36 пациентов с церебральной ишемией I степени, а во вторую подгруппу – 25 – с церебральной ишемией II степени. Результаты. У новорожденных первой подгруппы в отличие от контрольной группы отмечалась более низкая оценка состояния здоровья по шкале Апгар на 1 (р <0,001) и 5 минутах (р <0,001), а также масса тела (р <0,01) при рождении. В этой подгруппе при рождении регистрировалось большее число детей с бледностью кожи (χ2 = 6,95; р < 0,01), цианозом носогубного треугольника (χ2 = 6,77; р < 0,01), акроцианозом (χ2 = 5,12; р<0,05), приглушенностью тонов сердца (χ2 = 4,04; р < 0,05), систолическим шумом (χ2 = 5,48; р < 0,05), с развитием тахикардии (χ2 = 7,6; р < 0,01), неполной блокады правой ножки пучка Гиса (χ2 = 9,5; р < 0,01), умеренных (χ2 = 13,3; р < 0,001) и выраженных обменных нарушений в миокарде (χ2 = 5,99; р < 0,05). Во второй подгруппе в сравнении с контрольной группой и первой подгруппой регистрировались более низкие показатели по шкале Апгар на 1 (р < 0,001) и 5 минутах (р < 0,001) после рождения, а также массы тела (р < 0,01 и р < 0,001, соответственно). У новорожденных второй подгруппы в сравнении с первой подгруппой чаще отмечалась бледность кожи (χ2 = 4,31; р < 0,05), одышка (χ2 = 4,21; р < 0,05), приглушенность тонов сердца (χ2 = 5,07; р < 0,05), увеличение размеров печени (χ2 = 5,5; р < 0,05), брадикардия (χ2 = 4,21; р < 0,05), синусовая аритмия (χ2 = 4,6; р < 0,05), выраженные обменные нарушения в миокарде (χ2 = 5,07; р < 0,05) и повышение нагрузки на правое предсердие (χ2 = 10,9; р < 0,001). Заключение. У новорожденных от матерей, перенесших во втором триместре гестации обострение бронхиальной астмы легкой степени тяжести, ассоциированное с реактивацией хронической ЦМВ инфекции, формирование церебральной ишемии II степени характеризуется более частым, чем при церебральной ишемии I степени, развитием клинических и электрокардиографических нарушений. Они могут указывать на негативное влияние антенатальной гипоксии на периферическое кровообращение, способствующее дезадаптации сердечно-сосудистой системы в раннем неонатальном периоде.
Существует доказательства неблагоприятного влияния COVID-19 на течение беременности. Однако причины формирующихся при этом плацентарной недостаточности и анемии недостаточно изучены. Цель. Оценить прогностическую значимость определения интерлейкина 6 (IL-6), гипоксией индуцируемого фактора 1α (HIF- 1α) и ферритина в развитии плацентарной недостаточности у беременных женщин с COVID-19 среднетяжелого течения и анемией. Материалы и методы. В исследование были включены 78 беременных женщин, которые наблюдались в динамике, в соответствии с контрольными точками исследования. Исходная контрольная точка – на сроке 12–14 недель пациентки перенесли COVID-19 среднетяжелого течения (внебольничная пневмония). Вторая контрольная точка – на сроке 19–20 недель женщины были разделены на 2 группы в зависимости от наличия или отсутствия у них анемии: первая группа – женщины c COVID-19 и анемией легкой степени тяжести (n = 54), вторая группа – женщины с COVID-19 без анемии (n = 24). Третья контрольная точка – на сроке 30-32 недели пациентки первой группы были разделены на две подгруппы: подгруппу 1А составили женщины с признаками плацентарной недостаточности (n = 34), подгруппу 1Б – пациентки без признаков плацентарной недостаточности. Верификацию диагноза осуществляли путем обнаружения РНК SARS-CoV-2 в материале мазка из рото- и носоглотки методом полимеразной цепной реакции, а также с учетом современных клинико-рентгенологических критериев вирусного поражения легких при использовании специализированных методов лучевой диагностики (по показаниям). Содержание IL-6 (пг/мл), HIF-1α (нг/мл) и ферритина (мкг/л) определяли в образцах сыворотки крови методом твердофазного иммуноферментного анализа с помощью тест-систем ЗАО «Вектор-Бест» (Россия) и «BCM Diagnostics» (Австрия). Показатели красной крови (гемоглобин, общее количество эритроцитов) исследовались на гематологическом анализаторе Medonic M (Швейцария). Результаты. У женщин с COVID-19 и анемией наблюдались статистически значимо более высокие уровни IL-6 (p < 0,001), HIF-1α (p < 0,001) и ферритина (p < 0,001) по сравнению с пациентками с COVID-19 без анемии. У 63% женщин исследуемой группы была диагностирована плацентарная недостаточность. Выявлена сопряженность плацентарной недостаточности с концентрацией HIF-1α (r = 0,76; р < 0,05), IL-6 (r = 0,82; р < 0,05) и ферритина (r = 0,72; р < 0,05) у женщин с COVID-19 и анемией. Построена модель расчета прогностического индекса вероятности формирования плацентарной недостаточности (ПИПН): ПИПН= -12,84 + 2,486 × HIF-1α – 0,921 × IL-6 + 0,380 × ферритин. Пороговое значение прогностического индекса составило 1,204. При значениях ПИПН ≥ 1,204 риск формирования плацентарной недостаточности был высокий, то есть абсолютные значения ПИПН были прямо пропорциональны риску формирования плацентарной недостаточности. При ПИПН < 1,204 риск формирования плацентарной недостаточности отсутствовал. Заключение. Повышенные концентрации IL-6, HIF-1α и ферритина можно считать информативными предикторами диагноза плацентарная недостаточность у беременных женщин с COVID-19 среднетяжелого течения и анемией.
Целью исследования было изучение влияния сухих углекислых ванн (СУВ) и магнитотерапии (МТ) на показатели качества жизни, тяжести одышки, психологического состояния и уровня системного воспаления у пациентов, перенесших новую коронавирусную инфекцию (НКИ). Материалы и методы. Пациенты с перенесенной НКИ в анамнезе были разделены на 2 группы. Группа 1 (n = 20) получала физиотерапевтическое лечение в виде курса СУВ, группа 2 (n = 20) получала курс МТ. Была сформирована группа контроля (n = 20), в которую вошли относительно здоровые пациенты, не имеющие в анамнезе НКИ (отсутствие антител класса G к S-белку SARS-CoV-2 на момент включения в исследование), которые по полу и возрасту были сопоставимы с исследуемыми группами. Все пациенты при поступлении и пациенты групп 1 и 2 после окончания лечения проходили анкетирование с целью оценки качества жизни, уровня тревожности выраженности симптомов патологии дыхательной системы (SF-36, HADS, mMRS, шкала Борга). Аналогично был произведен забор плазмы крови с целью изучения уровня С-реактивного белка (СРБ) методом иммуноферментного анализа с помощью наборов производства Cloud Clone corp. (Ухань, Хубей, Китай). Результаты. Пациенты в постковидном периоде имели более низкие показатели оценки качества жизни и более высокие уровни тревожности и депрессии, одышки и отношения к физическим нагрузкам, чем лица контрольной группы. Применение СУВ и МТ улучшало показатели оценки качества жизни, снижение тревоги и депрессии, одышки и тяжести симптомов, вызванных физической нагрузкой у пациентов с постковидным синдромом по сравнению с лицами контрольной группы. Так, по результатам оценки анкетирования (SF-36), у пациентов 1 группы суммарное среднее улучшение качества жизни составило +9,3%, а у пациентов 2 группы – +4,55%. По шкале HADS, у пациентов группы 1 показатели тревожности снизились на 16,3%, депрессии – на 19,0%; 2 группы – на 8,6% и на 14,3%, соответственно. У лиц 1 группы балл, характеризующий выраженность одышки, по шкале mMRS снизился на 55%, отношение к физической нагрузке по шкале Борга уменьшилось на 50%; у лиц 2 группы – на 35% и 22,5%, соответственно. При применении СУВ у исследуемых также отмечалось снижение (p < 0,001) уровня СРБ (1,12 [0,42; 1,81] мг/мл до лечения и 0,91[0,26; 1,57] мг/мл после его завершения). Заключение. Таким образом, сухие углекислые ванны и магнитотерапия могут являться потенциально перспективными методами коррекции проявлений постковидного синдрома, однако требуется дополнительное изучение эффективности данных методов лечения на больших выборках.
Введение. Коронавирусная инфекция сопровождается разнообразными осложнениями со стороны нервной системы, в развитии которых определенная роль принадлежит окислительному стрессу и воспалению. Цель – выяснение связи между перенесенной коронавирусной инфекцией и содержанием продуктов окислительного стресса и провоспалительных интерлейкинов у больных с заболеваниями нервной системы. Материалы и методы. В исследовании приняли участие 158 больных с заболеваниями нервной системы. Из них 47 имели в анамнезе COVID-19. Контрольную группу составили 26 человек без клинических признаков острых и хронических заболеваний, сопоставимых по возрасту и полу. Концентрацию в крови неокисленных и окисленных форм липидов определяли с помощью УФ-спектроскопии, содержание гидроперекисей липидов и витамина Е – колориметрическим методом. Результаты. Содержание продуктов окислительного стресса в крови больных с заболеваниями нервной системы увеличено по отношению к здоровым людям, но значимых различий между пациентами, перенесшими коронавирусную инфекцию и не переболевшими ею, не было выявлено. Только в подгруппе больных с заболеваниями центральной нервной системы у перенесших коронавирусную инфекцию по отношению к пациентам, не имеющим ее в анамнезе, на 44% было выше содержание диеновых коньюгатов (p = 0,019), и на 56% – коньюгированных диенов и кетодиенов (р = 0,050). Содержание в крови продуктов окисления липидов различалось между подгруппами больных с острыми нарушениями мозгового кровообращения, заболеваниями центральной и периферической нервной системы. У больных с острыми нарушениями мозгового кровообращения, не имеющих в анамнезе COVID-19, по отношению к больным с заболеваниями центральной нервной системы содержание диеновых коньюгатов было выше на 81% (р = 0,032), коньюгированных диенов и кетодиенов – на 72% (0,042), а гидроперекисей липидов – на 45% (р = 0,016). У больных, перенесших COVID-19, уровень гидроперекисей липидов в подгруппе с острыми нарушениями мозгового кровообращения (80,0 ± 9,37 нмоль/мл) был выше на 37% (р = 0,03) и 32% (р = 0,03) по отношению к подгруппам с заболеваниями центральной и периферической нервной системы, в которых он составил 59,9 ± 7,07 нмоль/мл и 62,2 ± 3,6 нмоль/мл, соответственно. Сильные корреляции между уровнем в крови провоспалительных интерлейкинов и окислительно модифицированных липидов у больных, перенесших COVID-19, наиболее характерны для интерлейкинов 6 и 10. Заключение. Умеренные проявления окислительного стресса у больных с заболеваниями нервной системы в значительной мере обусловлены основным заболеванием, а не перенесенной коронавирусной инфекцией. В постковидном периоде у обследованных больных, переболевших COVID-19, сохраняется связь между проявлениями окислительного стресса и воспаления.
Введение. Рекуррентные респираторные инфекции у детей могут иметь широкий спектр клинических проявлений и вызывать долгосрочные последствия, которые требуют дополнительного изучения. Цель: определить клинико-функциональные особенности течения постинфекционной реактивности дыхательных путей у детей. Материалы и методы. В исследовании приняли участие 103 ребенка (38 девочек и 65 мальчиков), перенесших острую респираторную инфекцию. Средний возраст детей составил 12,2 ± 0,34 лет; рост 144,3 ± 1,88 см, вес 38,0 ± 1,63 кг. Детям проведена комплексная диагностика, включая анкетирование по расширенному опроснику API (Astma Predictive Index), забор биологического материала из рото- и носоглотки с целью обнаружения респираторных РНК- и ДНК-вирусов, забор периферической крови для определения специфических антител класса M и G к атипичным возбудителям методом иммуноферментного анализа. Были выполнены: спирометрия (ЖЕЛ (жизненная емкость легких), ОФВ1 (объем форсированного выдоха за первую секунду), соотношение ОФВ1/ЖЕЛ, ПОС (пиковая объемная скорость выдоха), МОС50 (максимальная объемная скорость в момент выдоха первых 50% ФЖЕЛ), МОС75 (максимальная объемная скорость в момент выдоха первых 75% ФЖЕЛ), СОС25-75 (средняя объемная скорость между 25% и 75% объема ФЖЕЛ)) с проведением ингаляционной бронходилатационной пробы с β2-агонистом короткого действия (сальбутамол), а также бронхопровокационная проба с ультразвуковой ингаляцией дистиллированной воды (ИДВ). Результаты. В первую группу были включены 53 ребенка с измененной реактивностью дыхательных путей на пробу ИДВ (ΔОФВ1 идв -5,6 [-13,0; 6,5])%, а во 2 группу – 38 детей, не реагирующих на пробу с ИДВ (ΔОФВ1 идв -2,9[-6,0; -1,6]%. Дети 1 группы имели более низкие значения спирометрических параметров в сравнении со 2 группой: ОФВ1/ЖЕЛ составил 96,0 [92,0; 102,0] и 101,0 [94,0; 104,0]% (p = 0,042); СОС25-75 68,0 [52,0; 88,0] и 80, 0[64,0; 95,0]% (p = 0,029), соответственно. При анализе респираторных возбудителей в 1 группе, относительно 2 группы, прослеживалась более высокая частота выявления специфических антител к Mycoplasma pneumoniae 42 и 18% (χ2 = 4,423; p < 0,05), соответственно. Кроме того, у детей 1 группы в 28% случаев определялось сочетанное инфицирование 2–4 возбудителями одновременно, в сравнении с детьми 2 группы – 8% случаев (χ2 = 4,594; p < 0,05). По результатам корреляционного анализа высокому уровню IgM к M. pneumonia соответствовал более выраженный ответ мелких дыхательных путей на бронхопровокацию ИДВ (ΔСОС25-75 ИДВ) (ρ = -0,63; p = 0,01). Заключение. Проведённое исследование подтверждает значительное влияние респираторных инфекций на реактивность дыхательных путей у детей, что проявляется в снижении спирометрических параметров, повышенной частоте выявления патогенспецифических антител и их связи с реакцией бронхов на осмотический стимул. Результаты нашего исследования подчёркивают важность ранней диагностики постинфекционной реактивности дыхательных путей у детей.
Введение. Энтеровирусная инфекция (ЭВИ) имеет глобальное распространение и широкий спектр клинических проявлений. Одной из наиболее часто регистрируемых специфических форм ЭВИ является герпангина. Цель. Оценить вклад герпангины в структуру клинических форм энтеровирусной инфекции в Дальневосточном федеральном округе (ДФО) и установить вызывающие её типы энтеровирусов. Материалы и методы. Для анализа заболеваемости герпангиной использовали статистические отчеты управлений Роспотребнадзора Дальневосточного федерального округа. Тип энтеровируса определяли с помощью секвенирования фрагмента гена капсидного белка VP1. Филогенетический анализ проведен для частичных нуклеотидных последовательностей штамма КВ-А2. Результаты. Анализ структуры клинических форм ЭВИ у населения ДФО за период с 2015 по 2024 гг. показал, что герпангина является одним из ведущих проявлений инфекции со средним удельным весом 33,4%. При обследовании 398 человек с герпангиной заболевание было выявлено в 92,5% случаев у детей до 6 лет. Были установлены 24 типа энтеровирусов, среди которых преобладали КВ-А10 (25,1%), КВ-А6 (24,6%), КВА5 (12,6%) и КВ-А2 (7,5%). При этом в разные годы доминировали разные энтеровирусы: в 2015-2016 гг., 2019 и 2023 гг. герпангину на Дальнем Востоке вызывал в основном КВ-А6; в 2017 и 2024 гг. – КВ-А10; в 2018 г. – КВА16; в 2021 г. – КВ-А5. В некоторых случаях вирус выявляли в респираторных образцах, взятых с 5 по 12 день от начала заболевания, что свидетельствовало о возможности длительного присутствия энтеровирусов в носоглотке и могло способствовать высокой заразности герпангины. Филогенетический анализ показал генетическое разнообразие популяции КВ-А2 и циркуляцию в ДФО генетических линий С и Е в один и тот же период. Заключение. Герпангина занимает значительную долю среди всех регистрируемых форм ЭВИ в ДФО. Возбудителями заболевания в большинстве случаев являются энтеровирусы вида Enterovirus alphacoxsackie. Для предотвращения распространения инфекции и возникновения вспышек заболевания необходимо уделять особое внимание профилактическим мероприятиям.
Цель. Оценить функциональное состояние малых дыхательных путей с использованием метода бодиплетизмографии и определить степень нарушения проводящей функции малых дыхательных путей (МДП) у пациентов с бронхиальной астмой (БА) легкой степени тяжести. Материалы и методы. Обследован 191 пациент с легкой БА. Группу контроля составили 36 условно здоровых добровольцев. С помощью бодиплетизмографии оценивали статические легочные объемы и емкости: функциональную остаточную емкость (ФОЕ), остаточный объем легких (ООЛ), общую емкость легких (ОЕЛ), соотношение ООЛ/ОЕЛ. Критерием дисфункции МДП считали ООЛ более 140%, ООЛ/ОЕЛ более 125%, ФОЕ более 130% от должных значений. Для оценки степени дисфункции МДП ориентировались на показатели в % отклонений от должных величин и значение z-score. Результаты. У 44 пациентов с БА выявлялась дисфункция МДП. Пациенты с дисфункцией МДП, с использованием кластерного анализа по параметрам, отражающим состояние МДП (ФОЕ, ООЛ и ООЛ/ОЕЛ) были классифицированы на 3 группы. Были установлены статистически значимые различия между кластерами по уровням ООЛ, ООЛ/ОЕЛ и показателю z-score для ООЛ и ООЛ/ОЕЛ. Для 1 кластера было характерно повышение ООЛ и ООЛ/ОЕЛ. У пациентов во 2-м кластере при сравнении с 1 кластером на фоне высоких уровней ООЛ и ООЛ/ОЕЛ в 50% случаев диагностировалось увеличение ФОЕ. В 3 кластере по сравнению с 1 и 2 кластерами отмечалось увеличение ОЕЛ на фоне высоких показателей ООЛ, ООЛ/ОЕЛ и ФОЕ в 55% случаев. По данным спирометрии установили снижение проходимости дыхательных путей, тестируемой величинами объема форсированного выдоха за первую секунду и максимальных объемных скоростей выдоха. Нарастание бронхиальной обструкции привело к уменьшению ЖЕЛ во 2 и 3 кластерах. Было показано, что нарушение функции МДП сопровождалось повышением уровней ООЛ, ООЛ/ОЕЛ. Заключение. Дисфункция МДП при легкой БА диагностирована в 23% случаев и сопровождается более выраженным снижением показателей, характерных для бронхобструктивного синдрома, в том числе, на уровне дистальных бронхов, наличием «воздушных ловушек». Установлены показатели, позволяющие определять степень нарушения функции МДП. Основными критериями степени дисфункции МДП у пациентов с БА легкой степени тяжести являются изменения показателей ООЛ, ООЛ/ОЕЛ и степень этих изменений по z-score.
Введение. Рецепторы горького вкуса (TAS2R) могут экспрессироваться в эпителии дыхательных путей и представляют интерес как терапевтические мишени для лечения бронхиальной астмы (БА). Ранее в ходе пилотного исследования мы идентифицировали наиболее экспрессируемые TAS2R в назальном эпителии больных БА и здоровых лиц методом секвенирования нового поколения (NGS). Цель. Определить взаимосвязь экспрессии TAS2R в назальном эпителии с контролем заболевания, маркерами воспаления, проходимостью и ремоделированием дыхательных путей у больных БА. Материалы и методы. В исследование было включено 173 больных БА (46,0 ± 1,13 лет, 60% женщины) различной тяжести (56,4% – легкая БА, 41,3% – среднетяжелая БА, 2,3% – тяжелая БА), преимущественно – с неконтролируемым течением заболевания (71%). Пациентам выполняли спирометрическое исследование с тестом на обратимость бронхиальной обструкции и морфометрию сегментарных бронхов B1 и B10 по данным компьютерной томографии (КТ) на фоне бронхолитика. Сывороточные концентрации общего IgE и цитокинов (интерлейкина (IL)-2, IL-4, IL-5, IL-6, IL-9, IL-10, IL-13, интерферона γ, фактора некроза опухоли α, IL-17A, IL-17F, IL-22) измеряли методами иммуноферментного и иммунофлуоресцентного анализа на микрочастицах (LEGENDplex), соответственно. Экспрессию генов TAS2R4, TAS2R5, TAS2R14, TAS2R20, TAS2R31 и TAS2R38 определяли на уровне мРНК методом количественной ПЦР с обратной транскрипцией в образцах, полученных из браш-биоптатов нижней носовой раковины. Результаты. Экспрессия всех генов, за исключением TAS2R4, была взаимосвязана. Снижение контроля БА по данным вопросника ACT сопровождалось увеличением экспрессии TAS2R20 (β = -0,20, p = 0,03) и TAS2R38 (β = -0,20, p = 0,02) после коррекции на пол, возраст, индекс массы тела, индекс курения, величину объема форсированного выдоха за 1 секунду и уровень IgE методом множественной линейной регрессии. Показатели вентиляционной функции легких и реакции на бронхолитик не были взаимосвязаны с экспрессией генов TAS2R. С помощью анализа PLS-SEM было установлено, что Th17 воспаление, преимущественно определяемое уровнем IL-17A, является основным фактором, ассоциированным как с КТ-признаками ремоделирования бронхов (обратная ассоциация с размерами бронхов – β = -0,57, p < 0,001; прямая – с утолщением бронхиальной стенки – β = 0,34, p = 0,05), так и с повышенной экспрессией TAS2R (наиболее существенно – с TAS2R5 β = 0,40, p = 0,01 и TAS2R20 β = 0,41, p = 0,01). Само ремоделирование бронхов также сочеталось с апрегуляцией TAS2R, в особенности, TAS2R5 (R2 = 0,17, p = 0,002) и TAS2R20 (R2 = 0,15, p = 0,006), при этом значимая ассоциация с экспрессией прослеживалась только для латентной переменной, отражающей размеры бронхов (β = -0,33, p < 0,001 – как для TAS2R5, так и для TAS2R20). Заключение. Мы обнаружили признаки увеличения экспрессии генов TAS2R при снижении контроля БА, а также у пациентов с более выраженным бронхиальным ремоделированием и повышенным уровнем IL-17A в сыворотке крови. При условии, что индукция TAS2R носит вторичный, компенсаторный характер, рецепторы TAS2R5 и TAS2R20 представляют интерес как наиболее перспективные объекты для дальнейшего изучения.
Введение. Патогенетические механизмы формирования бронхиальной астмы (БА) во многом основаны на процессах изменения энергетического состояния клеток (в том числе иммунной системы), большую роль в котором играет состояние митохондриального мембранного потенциала (ММП). Снижение последнего проявляется уже на ранних этапах развития БА и может являться одним из ключевых признаков ее течения. Течение и прогрессирование БА способны усугубляться под влиянием разных факторов, в том числе твердых взвешенных частиц (ТВЧ) атмосферного воздуха. Однако сведения об изменении ММП в отдельных лимфоцитарных субпопуляциях при БА под воздействием ТВЧ практически отсутствуют. Цель. Установление нарушений мембранного потенциала митохондрий CD4+ клеток больных бронхиальной астмой легкой степени тяжести под воздействием ТВЧ приземного слоя атмосферного воздуха. Материалы и методы. В исследование in vitro были включены образцы периферической крови 131 больных БА и 60 условно здоровых лиц. В качестве нагрузки при проведении эксперимента использовали модельные взвеси веществ, имитирующие многокомпонентное загрязнение атмосферного воздуха г. Владивостока. Уровни интенсивности нарушений ММП (от 1 до 5) CD4+ определяли методом проточной цитофлуориметрии. При анализе использовали коэффициент ММП (кММП). Результаты. При БА основные перестройки процентного соотношения лимфоцитарной субпопуляции происходили среди клеток, имеющих уровни ММП-1, ММП-2 и ММП-3: наблюдалось уменьшение количества клеток с высоким ММП и увеличение числа CD4+, характеризующихся снижением структурно-функциональных свойств (ММП-2 и ММП-3). Воздействие ТВЧ вызывало перераспределение клеток между уровнями ММП у больных БА. При снижении контроля БА были установлены более выраженные нарушения энергетического состояния клеток. У больных при контролируемом течении БА по сравнению с частично контролируемом кММП был ниже на 82,9%. При воздействии ТВЧ на больных БА кММП снижался относительно групп без нагрузки на 27,2% и 16,3% при контролируемом и частично контролируемом течении соответственно. Заключение. Установлены особенности нарушения мембранного потенциала митохондрий CD4+ клеток больных бронхиальной астмой легкой степени тяжести под воздействием ТВЧ приземного слоя атмосферного воздуха в зависимости от уровня контроля заболевания. Оценка перераспределения уровней ММП и коэффициента ММП как интегрального показателя энергетического состояния CD4+ клеток может способствовать раннему выявлению нарушений энергетического обмена при БА, что позволит оптимизировать профилактику прогрессирования патологии.
Введение. Хроническая обструктивная болезнь легких (ХОБЛ) – распространенное заболевание с высокой социальной значимостью, в патогенезе которого существенную роль может играть реакция альвеолярного эпителия на сигаретный дым. Цель. Комплексная характеристика транскриптомных изменений в клетках A549, возникающих в ответ на действие экстракта сигаретного дыма (ЭСД), включая анализ дифференциальной экспрессии генов и ключевых сигнальных путей, с оценкой их потенциальной роли в развитии патологического процесса при ХОБЛ. Материалы и методы. Клетки A549 выращивали в среде DMEM до 80% конфлюэнтности, а затем инкубировали с 5% ЭСД или в контрольных условиях в течение 24 часов (n = 3 на каждое условие). Выделенную тотальную РНК подвергали обогащению для получения мРНК. Секвенирование выполняли на секвенаторе MGISEQ-200 в режиме SE50. Обработка данных включала картирование прочтений (Salmon), анализ дифференциальной экспрессии (DESeq2) и функционального обогащения генов (Cytoscape). Результаты. Действие ЭСД сопровождалось признаками дезорганизации актинового цитоскелета (ингибирование Rho ГТФаз, даунрегуляция ACTB) и стресса эндоплазматического ретикулума с парадоксальной активацией mTORC1 сигналинга на фоне подавления транскрипции, пролиферации и апоптоза, что в совокупности может быть охарактеризовано как метаболически активный клеточный стазис. Одновременно с этим отмечалось усиление протеасомной деградации и антигенной презентации собственных, вероятно, дефектных белков с целью стимуляции иммунологического надзора. В то время как провоспалительный сигналинг, в целом, был ослаблен, увеличивалась экспрессия IL1A, SPP1 и CSF3, что может способствовать привлечению и активации нейтрофилов, макрофагов и моноцитов in vivo. Предполагаемые нарушения эффероцитоза (за счет апрегуляции ANXA5) и индукции апоптоза цитотоксическими Tклетками (вследствие нарушения эндоцитоза гранзимов и ингибирования каспаз) могут приводить к формированию хронического воспаления с аутоиммунным компонентом. Заключение. Активация mTORC1 сигналинга и презентации аутоантигенов на фоне стресса эндоплазматического ретикулума, а также потенциальное снижение способности цитотоксических T-клеток вызывать апоптоз, может являться ключевыми механизмами патогенеза ХОБЛ, опосредующими повреждение альвеолярного эпителия под действием сигаретного дыма.
Статистика статьи
Статистика просмотров за 2025 - 2026 год.
Издательство
- Издательство
- ДНЦ ФПД
- Регион
- Россия, Благовещенск
- Почтовый адрес
- Амурская область, г. Благовещенск, ул. Калинина, д.22
- Юр. адрес
- Амурская область, г. Благовещенск, ул. Калинина, д.22
- ФИО
- Полянская Елена Викторовна (Директор)
- E-mail адрес
- dncfpd@dncfpd.ru
- Контактный телефон
- +8 (416) 2772800
- Сайт
- https:/cfpd.ru