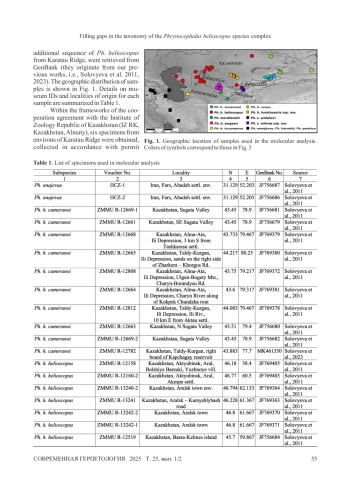
В последние годы комплекс видов Phrynocephalus helioscopus был тщательно изучен, но некоторые его представители так и не были классифицированы. На основании морфологических различий и расхождений в последовательностях гена COI (митохондриальной ДНК) в данной статье описаны два новых подвида в составе комплекса видов Phrynocephalus helioscopus: Ph. helioscopus karatauensis ssp. nov. из окрестностей хребта Каратау в Казахстане и Ph. saidalievi orlovae ssp. nov. с правого берега Амударьи в Ферганской долине в Узбекистане. Два новых подвида можно отличить от других представителей видового комплекса по сочетанию нескольких морфологических признаков.
Phrynocephalus helioscopus species complex have been thoroughly studied during recent years, but several lineages remained unassigned. Based on the morphological differences and divergence in COI (mtDNA) gene sequences, two new subspecies are described in the present article within the Phrynocephalus helioscopus species complex: Ph. helioscopus karatauensis ssp. nov. from the environs of Karatau Ridge in Kazakhstan and Ph. saidalievi orlovae ssp. nov. from the right bank of the Amu-Darya river in Fergana valley in Uzbekistan. The two new subspecies can be distinguished from other members of the species complex by a combination of several morphological features.
Идентификаторы и классификаторы
- SCI
- Биология
Представители этого видового комплекса обитают на обширной территории от Ирана и Армении на западе до западной Монголии на востоке. До недавнего времени в этот комплекс входили только два вида: (Pallas, 1771) и Phrynocephalus helioscopus Ph. helioscopus Ph. persicus De Filippi, 1863 (Барабанов, Ананьева, 2007). Но как только началось широкое применение молекулярнофилогенетических методов, было описано множество подвидов обоих видов (Соловьева и др., 2011, 2012; Мельников и др., 2013), некоторые из которых позже были выделены в отдельные виды (Мэйси и др., 2018; Соловьева и др., 2023). Последняя оценка разнообразия Phrynocephalus, проведенная Соловьевой и др. (2023), В комплекс видов Ph. helioscopus включено до 16 таксонов видового уровня. В целом представители этого комплекса видов относятся к подроду (Соловьева и др., 2018).
Members of the species complex inhabit vast territory from Iran and Armenia in the west to western Mongolia in the east. Until recently, only two species were recognized within this complex, (Pallas, 1771) and Phrynocephalus helioscopus Ph. helioscopus Ph. persicus De Filippi, 1863 (Barabanov, Ananjeva, 2007). But once the wave of usage of molecular phylogenetic methods started, many subspecies were described within both species (Solovyeva et al., 2011, 2012; Melnikov et al., 2013), with some of them later raised to full species status (Macey et al., 2018; Solovyeva et al., 2023). The latest assessment of Phrynocephalus diversity by Solovyeva et al. (2023) recognized up to 16 species-level units within the Ph. helioscopus species complex. Overall, the members of the species complex are classified within the subgenus (Solovyeva et al. 2018).
Список литературы
1. Барабанов А. В., Ананьева Н. Б. Каталог доступных научных названий видовых групп ящериц рода Phrynocephalus Kaup, 1825 (Reptilia, Sauria, Agamidae). Zootaxa, 2007, т. 1399, с. 1–56. DOI: 10.11646/zootaxa.1399.1.1
2. Банников А. Г., Даревский И. С., Ищенко В. Г., Рустамов А. К., Щербак Н. Н. Справочник по земноводным и пресмыкающимся фауны СССР. М.: Просвещение, 1977. 415 с.
3. Бондарцев А. С. Цветовая гамма (пособие для биологов в научных и прикладных исследованиях). Москва, Ленинград, Изд-во Академии наук СССР, 1954. 28 с.
4. Де Кейруш К. Видовые концепции и разграничение видов. Систематическая биология, 2008, том 56, выпуск 6, стр. 879-886. DOI: 10.1080/10635150701701083
5. Дюфресн К., Поярков Н. А., Яблонски Д. Признание большего биоразнообразия без увеличения количества видов. Proceedings of the National Academy of Sciences of the United States of America, 2023, том 120, № 40, статья № e2302424120. DOI: 10.1073/pnas.2302424120
6. Холл Т. BioEdit: Удобный редактор для выравнивания биологических последовательностей и программа для анализа для Windows 95/98/NT. Симпозиум нуклеиновых кислот, 1999, том 41, с. 95-98.
7. Хуэлсенбек Дж. П., Ронквист Ф. MRBAYES: байесовский вывод филогенетических данных. Bioinformatics, 2001, т. 17, с. 754–755.
8. База данных iNaturalist. Доступно по адресу: https://www.inaturalist.org (по состоянию на 3 мая 2024 года).
9. Иванова Н. В., Де Ваард Дж., Хеберт П. Д. Н. Недорогой и удобный для автоматизации протокол выделения высококачественной ДНК. Molecular Ecology Notes, 2006, т. 6, вып. 4, с. 998–1002. DOI: 10.1111/j.1471-8286.2006.01428.x
10. Kalyaanamoorthy S., Minh B. Q., Wong T. K., Von Haeseler A., Jermiin L. S. ModelFinder: быстрый выбор модели для точных филогенетических оценок. Nature Methods, 2017, т. 14, вып. 6, с. 587–589. DOI: 10.1038/nmeth.4285
11. Ле С., Жосс Ж., Юссон Ф. FactoMineR: пакет для многомерного анализа. Journal of Statistical Software, 2008, т. 25, № 1, с. 1–18. 1. DOI: 10.18637/jss.v025.i01
12. Мейси Дж. Р., Шульте Дж. А., Ананьева Н. Б., Ван Дайк Э. Т., Ван Ю., Орлов Н., Шафии С., Робинсон М. Д., Дуйсебаева Т., Фройнд Г. С., Фишер К. М., Лю Д., Папенфус Т. Дж. Молекулярно-филогенетическая гипотеза для азиатского рода агамовых ящериц Phrynocephalus выявляет дискретные биогеографические клады, связанные с тектоникой плит. Зоотакса, 2018, том 4467, № 1, с. 1-81. DOI: 10.11646/zootaxa.4467.1.1
13. Мельников Д., Мельникова Е., Назаров Р., Раджабизаде М. Таксономический обзор комплекса Phrynocephalus persicus De Filippi, 1863 с описанием нового вида из Загроса, Южный Иран. Современные исследования в области герпетологии, 2013, том 13, вып. 1-2, с. 34-46.
14. Минь Б. К., Нгуен М. А. Т., фон Хезелер А. Сверхбыстрая аппроксимация для филогенетического бутстреппинга. Молекулярная биология и эволюция, 2013, том 30, вып. 5, с. 1188-1195. DOI: 10.1093/molbev/mst024
15. Надь З. Т., Сонет Г., Глау Ф., Венс М. Первая крупномасштабная оценка ДНК-штрихкодирования рептилий в очаге биоразнообразия на Мадагаскаре с использованием новых праймеров для гена COI. PLoS ONE, 2012, том 7, статья e34506. DOI: 10.1371/journal.pone.0034506
16. Назаров Р. А., Абдураупов Т. В., Шепеля Е. Ю., Грицина М., Мельников Д. А., Бюлер М. Д., Лапин Дж., Поярков Н. А., Грисмер Дж. Л. Ферганская долина — изолированный ареал биоразнообразия: обсуждение эндемичной герпетофауны и описание двух новых видов Alsophylax (Sauria: Gekkonidae) из восточного Узбекистана. Животные, 2023, том 13, статья № 2516. DOI: 10.3390/ani13152516
17. Нгуен Л. Т., Шмидт Х. А., фон Хезелер А., Минь Б. К. IQ-ДЕРЕВО: быстрый и эффективный стохастический алгоритм для оценки филогенеза с максимальной вероятностью. Молекулярная биология и эволюция, 2015, том 32, выпуск 1, стр. 268-274. DOI: 10.1093/molbev/msu300
Основная команда 18. R. R: Язык и среда для статистических вычислений. Вена, Австрия, R Foundation for Statistical Computing 2021. Доступно по адресу: https://www.R-project.org (по состоянию на 3 мая 2024 года).
19. Рамбо А., Драммонд А. Дж. Tracer v1. 5. 2007. Доступно по адресу: http://beast.bio.ed.ac.uk/Tracer (по состоянию на 3 мая 2024 года).
20. Ронквист Ф., Уэльзенбек Дж. Байесовский филогенетический вывод в смешанных моделях. Биоинформатика, 2003, том 19, выпуск 12, стр. 1572-1574. DOI: 10.1093/bioinformatics/btg180
21. Самбрук Дж., Фрич Э. Ф., Маниатис Т. Молекулярное клонирование: лабораторное руководство. 2-е изд. Нью-Йорк, издательство Cold Spring Harbour Laboratory, 1989. 385 стр.
22. Сатторов Т. Phrynocephalus helioscopus saidalievi ssp. n. (Саурия, рептилия) - новый подвид жабоголовой агамы из Ферганской долины. Вестник зоологии, 1981, т. 1, с. 73-75.
23. Соловьева Е. Н., Поярков Н. А., Дунаев Е. А., Дуйсебаева Т. Н., Банникова А. А. Молекулярная дифференциация и систематика надвидового комплекса солнечников Phrynocephalus helioscopus (Pallas 1771) (Reptilia: Agamidae). Генетика, 2011, т. 7, с. 952–967.
24. Соловьева Е. Н., Дунаев Е. А., Поярков Н. А. Систематика подвидов видового комплекса солнечников (Phrynocephalus helioscopus (Pallas 1771)) (Squamata, Agamidae). Зоологический журнал, 2012, том 91, № 11, с. 1-20.
25. Соловьева Е. Н., Лебедев В. С., Дунаев Е. А., Назаров Р. А., Банникова А. А., Че Дж., Мерфи Р. У., Поярков Н. А. Кенозойская аридизация в Центральной Евразии способствовала диверсификации круглоголовых агамовых (Phrynocephalus; Agamidae, Reptilia). PeerJ, 2018, том 6, статья № e4543. DOI: 10.7717/peerj.4543
26. Соловьева Е. Н., Дунаев Е. А., Назаров Р. А., Бондаренко Д. А., Поярков Н. А. COI-баркодирование и оценка видовой принадлежности круглоголовых агамовых (род Phrynocephalus, Agamidae, Squamata) выявили ранее неизвестное разнообразие в Центральной Евразии. Разнообразие, 2023, том 15, выпуск 2, статья № 149. DOI: 10.3390/d15020149
27. Вайсси П., Монж А., Вайсси Ф. Х. Пакет “Фактошины”. 2024. DOI: 10.32614/CRAN.package.Фактошины.
28. Ву Н., Ван С., Дуйсебаева Т. Н., Чен Д., Али А., Го С. География и изменения климата в прошлом повлияли на эволюцию широко распространенной ящерицы в засушливых районах Центральной Азии. Molecular Phylogenetics and Evolution, 2023, том 184, статья № 107781.
1. Barabanov A. V., Ananjeva N. B. Catalogue of the available scientific species-group names for lizards of the genus Phrynocephalus Kaup, 1825 (Reptilia, Sauria, Agamidae). Zootaxa, 2007, vol. 1399, pp. 1-56. DOI: 10.11646/zootaxa.1399.1.1
2. Bannikov A. G., Darevsky I. S., Ishchenko V. G., Rustamov A. K., Szczerbak N. N. Guide to Amphibians and Reptiles of the USSR Fauna. Moscow, Prosveshchenie, 1977. 415 p. (in Russian).
3. Bondartsev A. S. Color Scale (a manual for biologists in scientific and applied research). Moscow, Leningrad, USSR Academy of Sciences Publ., 1954. 28 p. (in Russian).
4. De Queiroz K. Species concepts and species delimitation. Systematic Biology, 2008, vol. 56, iss. 6, pp. 879-886. DOI: 10.1080/10635150701701083
5. Dufresnes C., Poyarkov N. A., Jablonski D. Acknowledging more biodiversity without more species. Proceedings of the National Academy of Sciences of the United States of America, 2023, vol. 120, no. 40, article no. e2302424120. DOI: 10.1073/pnas.2302424120
6. Hall T. BioEdit: A User-Friendly Biological Sequence Alignment Editor and Analysis Program for Windows 95/98/NT. Nucleic Acids SymPh. ser., 1999, vol. 41, pp. 95-98.
7. Huelsenbeck J. P., Ronquist F. MRBAYES: Bayesian inference of phylogeny. Bioinformatics, 2001, vol. 17, pp. 754-755.
8. iNaturalist database. Available at: https://www.inaturalist.org (accessed May 3, 2024).
9. Ivanova N. V., DeWaard J., Hebert P. D. N. An inexpensive, automation friendly protocol for recovering high quality DNA. Molecular Ecology Notes, 2006, vol. 6, iss. 4, pp. 998-1002. DOI: 10.1111/j.1471-8286.2006.01428.x
10. Kalyaanamoorthy S., Minh B. Q., Wong T. K., Von Haeseler A., Jermiin L. S. ModelFinder: Fast model selection for accurate phylogenetic estimates. Nature Methods, 2017, vol. 14, iss. 6, pp. 587-589. DOI: 10.1038/nmeth.4285
11. Lê S., Josse J., Husson F. FactoMineR: A package for multivariate analysis. Journal of Statistical Software, 2008, vol. 25, no. 1, pp. 1-18. 1. DOI: 10.18637/jss.v025.i01
12. Macey J. R., Schulte J. A., Ananjeva N. B., Van Dyke E. T., Wang Y., Orlov N., Shafiei S., Robinson M. D., Dujsebayeva T., Freund G. S., Fischer C. M., Liu D., Papenfuss T. J. A molecular phylogenetic hypothesis for the Asian agamid lizard genus Phrynocephalus reveals discrete biogeographic clades implicated by plate tectonics. Zootaxa, 2018, vol. 4467, no. 1, pp. 1-81. DOI: 10.11646/zootaxa.4467.1.1
13. Melnikov D., Melnikova E., Nazarov R., Radjabizadeh M. Taxonomic revision of Phrynocephalus persicus De Filippi, 1863 complex with description of a new species from Zagros, Southern Iran. Current Studies in Herpetology, 2013, vol 13, iss. 1-2, pp 34-46.
14. Minh B. Q., Nguyen M. A. T., von Haeseler A. Ultrafast approximation for phylogenetic bootstrap. Molecular Biology and Evolution, 2013, vol. 30, iss. 5, pp. 1188-1195. DOI: 10.1093/molbev/mst024
15. Nagy Z. T., Sonet G., Glaw F., Vences M. First Large-scale DNA barcoding assessment of reptiles in the biodiversity hotspot of Madagascar, based on newly designed COI primers. PLoS ONE, 2012, vol. 7, article no. e34506. DOI: 10.1371/journal.pone.0034506
16. Nazarov R. A., Abduraupov T. V., Shepelya E. Y., Gritsina M., Melnikov D. A., Buehler M. D., Lapin J., Poyarkov N. A., Grismer J. L. The Fergana Valley is an isolate of biodiversity: A discussion of the endemic herpetofauna and description of two new species of Alsophylax (Sauria: Gekkonidae) from eastern Uzbekistan. Animals, 2023, vol. 13, article no. 2516. DOI: 10.3390/ani13152516
17. Nguyen L. T., Schmidt H. A., von Haeseler A., Minh B. Q. IQ-TREE: A fast and effective stochastic algorithm for estimating maximum likelihood phylogenies. Molecular Biology and Evolution, 2015, vol. 32, iss. 1, pp. 268-274. DOI: 10.1093/molbev/msu300
18. R Core Team. R: A Language and Environment for Statistical Computing. Vienna, Austria, R Foundation for Statistical Computing 2021. Available at: https://www.R-project.org (accessed May 3, 2024).
19. Rambaut A., Drummond A. J. Tracer v1. 5. 2007. Available at: http://beast.bio.ed.ac.uk/Tracer (accessed May 3, 2024).
20. Ronquist F., Huelsenbeck J. MrBayes 3: Bayesian phylogenetic inference under mixed models. Bioinformatics, 2003, vol. 19, iss. 12, pp. 1572-1574. DOI: 10.1093/bioinformatics/btg180
21. Sambrook J., Fritsch E. F., Maniatis T. Molecular Cloning: A Laboratory Manual. 2nd ed. New York, Cold Spring Harbour Laboratory Press, 1989. 385 p.
22. Sattorov T. Phrynocephalus helioscopus saidalievi ssp. n. (Sauria, Reptilia) - a new subspecies of the toad-headed agama from Fergana Valley. Vestnik Zoologii, 1981, vol. 1, pp. 73-75 (in Russian).
23. Solovyeva E. N., Poyarkov N. А., Dunayev Е. А., Duysebaeva T. N., Bannikova А. А. Molecular differentiation and systematics of superspecies complex of sunwatcher toad-headed agama Phrynocephalus superspecies helioscopus (Pallas 1771) (Reptilia: Agamidae). Genetika, 2011, vol. 7, pp. 952 - 967.
24. Solovyeva E. N., Dunayev Е. А. Poyarkov N. А. Subspecies systematics of the species complex of sunwatchet toad-headed agama (Phrynocephalus helioscopus (Pallas 1771)) (Squamata, Agamidae). Zoologicheskiy zhurnal, 2012, vol. 91, no. 11, pp. 1-20 (in Russian).
25. Solovyeva E. N., Lebedev V. S., Dunayev E. A., Nazarov R. A., Bannikova A. A., Che J., Murphy R. W., Poyarkov N. A. Cenozoic aridization in Central Eurasia shaped diversification of toad-headed agamas (Phrynocephalus; Agamidae, Reptilia). PeerJ, 2018, vol. 6, article no. e4543. DOI: 10.7717/peerj.4543
26. Solovyeva E. N., Dunayev E. A., Nazarov R. A., Bondarenko D. A., Poyarkov N. A. COI-barcoding and species delimitation assessment of toad-headed agamas (genus Phrynocephalus, Agamidae, Squamata) reveal unrecognized diversity in Central Eurasia. Diversity, 2023, vol. 15, iss. 2, article no. 149. DOI: 10.3390/d15020149
27. Vaissie P., Monge A., Vaissie F. H. Package ‘Factoshiny’. 2024. DOI: 10.32614/CRAN.package.Factoshiny
28. Wu N., Wang S., Dujsebayeva T. N., Chen D., Ali A., Guo X. Geography and past climate changes have shaped the evolution of a widespread lizard in arid Central Asia. Molecular Phylogenetics and Evolution, 2023, vol. 184, article no. 107781.
Выпуск
Другие статьи выпуска
8 февраля 2024 г. Научно-исследовательский Зоологический музей МГУ им. М. В. Ломоносова отметил юбилей заведующего секторомгерпетологии Валентины Федоровны Орловой (Положихиной).
Приводятся данные по распространению обыкновенной медянки в Дагестане. Карта с точками находок медянки включает 103 местонахождения вида. Обсуждаются вопросы биотопической приуроченности и экологии вида в регионе.
Изучено заселение амурским полозом Elaphe schrenckii и узорчатым полозом E. dione опилочной «кучи», расположенной среди отходов лесоперерабатывающего комплекса, в период высоких паводков р. Амур. Полозы обоих видов обитают здесь круглогодично с 2013 г. Убежища в виде «парящих» трещин (глубина 2 - 2.5 м, температура зимой до +18°С) со снежной «крышей» над ними служат змеям укрытиями от холодов. На групповой зимовке по численности доминирует E. schrenckii. С мая по сентябрь 2023 г. на контрольной площадке собрано 127 выползков обоих видов полозов (из них - 104 E. schrenckii), проведена косвенная оценка ряда фаз их жизненного цикла в активный период (размножение, выпаривание самками потомства, появление сеголеток). По сохранившимся линным шкурам E. schrenckii и E. dione исследованы морфологические признаки самцов и самок (L., L. cd., L./L. cd., Sq., Ventr., S. cd., A, Lab., Temp.). Обсуждены и предложены мероприятия по сохранению иннокентьевской популяции полозов, обитающих в опилочной «куче».
Проанализирован ряд аспектов зимовки живородящей ящерицы (Zootoca vivipara) в азиатской части ареала. Использованы результаты собственных полевых работ за период с 1971 по 2022 г. в Республике Алтай (Алтайский государственный природный биосферный заповедник), Томской, Кемеровской, Челябинской и Свердловской областях. В пределах 17 локалитетов предгорной и равнинной частях юга Западной Сибири (51°22’ - 57°04’ с. ш., 57°33’ - 88°08’ в. д.) зарегистрированы 54 зимовки. В зимовальных убежищах отмечено 173 ящерицы разного пола и возраста. Наибольшее количество зимовок - 75.9% обнаружено в агрогенной почве (огороды, пашни, сады). В почве на глубине 15 - 25 см зимовальных убежищ в 2.8 раза и число залегших в них в спячку ящериц в 1.5 раза больше, чем на глубине 0 - 15 см (p < 0.01). Ящерицы проводят зимовку поодиночке (44.2%) или в группах (2 особи - 20.4%, 3 - 19%, 4 и 5 - по 5.6%, 6 - 7.1%, 9, 14 и 40 - по 1.85%). Тело одиночной зимующей особи свернуто в кольцо или уплощенную спираль. В группах ящерицы находились в клубках разного размера. У Z. vivipara выявлены флуктуации в сроках ухода в зимовку и появления весной, а также длительности неактивного периода, что определяется комплексом экологических факторов конкретного года. Результаты исследований в заповеднике с 1971 по 2017 г. показывают, что Z. vivipara можно считать фенологическим биоиндикатором, что проявляется в смещении выхода ящериц с зимовки на более ранние сроки.
Приведены сведения об истории формирования мемориальной коллекции земноводных и пресмыкающихся, полученных Зоологическим музеем Московского университета из торгового Музея Годеффруа в конце XIX в. Коллекция включает 16 видов амфибий (20 экз.) и 70 видов рептилий (86 экз.). Дан полный перечень материалов, их таксономический и географический анализ. Большинство амфибий коллекции Годеффруа принадлежат к австралийским квакшам (Hylidae: Pelodryadinae). Больше половины ящериц (52.2%) относятся к семейству Scincidae. Среди змей доминируют Elapidae (60.0%, и все они - морские змеи), причем почти 80% из них Hydrophiinae. Значительная часть видов рептилий происходят из Австралии (около 63%), 53.3% образцов принадлежат к эндемикам континента. Установлено, что Calyptotis scutirostrum (№ Re-2212 ZMMU) является топотипом. Более 60 видов коллекции Годеффруа в разное время демонстрировали в экспозиции музея, часть из них выставлены в витринах до сих пор. Представлены сведения о возможных сборщиках этих материалов.
Мы провели комплексный таксономический пересмотр миниатюрных сфеноморфиновых сцинков из Вьетнама и Камбоджи на основе морфологического анализа и ДНК-штрихкодирования гена COI. Наши данные позволили выделить новый вид, Sphenomorphus valentinae sp. nov., из национального парка Чу Янг Син, провинция Даклак, Вьетнам. Новый вид отличается от других сородичей следующим сочетанием морфологических признаков: сцинк длинноногий и коротконогий с пятидактильными конечностями; длина тела 28,1-37,5 мм, обхват 49,4-62,3 мм; ушное отверстие скрыто; чешуйки гладкие; надназальные и постназальные отсутствуют; нижнее веко подвижное и чешуйчатое; лобные части две, раздельные; надглазничные кости - четыре; надсосудистые - восемь; предглазничные кости - две; первичные височные кости - три; надгубные кости - шесть, сначала сросшиеся с носовыми; подгубные кости - четыре; подбородочные щитки - три пары; затылочные кости не увеличены; паравертебральные чешуйки - 50-55 рядов; брюшные чешуйки - 52-56 рядов; средние чешуйки - 18 рядов; пять подчелюстных пластинок под безымянным пальцем; шесть подпальцевых пластинок под четвертым пальцем; дорсальные поверхности коричнево-бежевые, переливающиеся, с темными пятнами, образующими четыре тонкие продольные линии; брюшные поверхности от светло-коричневых до серовато-розовых; светлая дорсолатеральная полоса с темно-коричневой каймой на брюшной стороне проходит от заднего края глаза до хвоста. Мы также показываем, что Sphenomorphus sheai, обнаруженный в провинции Куангнам во Вьетнаме, является младшим синонимом Lygosoma veunsaiense, найденного в провинции Ратанакири в Камбодже. Мы даем новое описание этого таксона и предварительно относим его к виду Sphenomorphus veunsaiensis comb. nov. (Geissler, Hartmann & Neang, 2012). Мы приводим новую информацию о распространении и обсуждаем расхождения в таксономии и диагностике S. veunsaiensis, S. tridigitus, S. tetradactylus и Leptoseps poilani в Индокитае. Для лучшего понимания разнообразия миниатюрных сфеноморфных сцинков в этом регионе необходимы дальнейшие полевые исследования и изучение имеющихся типовых образцов.
Издательство
- Издательство
- СГУ
- Регион
- Россия, Саратов
- Почтовый адрес
- 410012, г. Саратов, ул. Астраханская, 83
- Юр. адрес
- 410012, г. Саратов, ул. Астраханская, 83
- ФИО
- Чумаченко Алексей Николаевич (Ректор)
- E-mail адрес
- rector@sgu.ru
- Контактный телефон
- +7 (845) 2261696
- Сайт
- https://www.sgu.ru/