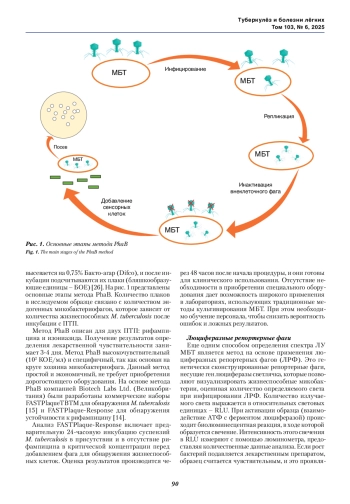
В последние годы возрос интерес к фаговым технологиям как к перспективным методам быстрого определения спектра лекарственной чувствительности бактерий, в том числе Mycobacterium tuberculosis. Микобактериофаги способны специфически инфицировать M. tuberculosis, что дает возможность разработки новых эффективных, экономичных диагностических тестов, а также принципиально новых лекарственных препаратов для лечения туберкулеза. Проанализированы 27 источников, описывающие основные методы, используемые для определения спектра лекарственной чувствительности M. tuberculosis с помощью микобактериофагов. Преимуществом этих методов являются: быстрота (получение результатов за 24-96 часов с момента начала анализа); специфичность (основаны на строгом круге хозяев фага). Это позволяет в короткие сроки выявлять наличие возбудителя туберкулеза и его лекарственную чувствительность к противотуберкулезным препаратам.
Идентификаторы и классификаторы
В связи с распространением во всем мире туберкулеза с лекарственной устойчивостью, включая множественную (МЛУ), пре-широкую (пре-ШЛУ) и широкую (ШЛУ) лекарственную устойчивость, продолжает оставаться актуальным быстрое определение конкретных противотуберкулезных (ПТП), к которым устойчив выделенный от больного штамм микобактерий туберкулеза (МБТ).
Список литературы
1. Беляев Д.В., Вахрушева Д.В., Винокуров А.С. и др. Тестирование лекарственной чувствительности клинических изолятов Mycobacterium tuberculosis методом пропорций: методические рекомендации. Москва: РОФ, 2022.
2. Елисеев П.И., Байракова А.Л., Ганджалян Т.А., Зорина В.В., Баланцев Г.А., Марьяндышев А.О. Мониторинг мутаций, ассоциированных с устойчивостью Mycobacterium tuberculosis к противотуберкулезным препаратам // Туберкулез и болезни легких. - 2025. - Т. 103, № 1. - С. 45-53. DOI: 10.58838/2075-1230-2025-1031-45-53
3. Лапенкова М.Б., Арустамова Г.А., Аляпкина Ю.С., Филиппов П.H., Лазебный С.В., Владимирский М.А. Тест-система для фенотипического определения лекарственной чувствительности клинических изолятов микобактерий туберкулеза на основе применения микобактериофагов // Туберкулез и болезни легких. - 2020. - Т. 98, № 8. - С. 14-22. DOI: 10.21292/2075-1230-2020-98-8-14-22
4. Banaiee N., Bobadilla-Del-Valle M., Bardarov S. Jr., Riska P.F., Small P.M., Ponce-De-Leon A., Jacobs W.R. Jr., Hatfull G.F., Sifuentes-Osornio J. Luciferase reporter mycobacteriophages for detection, identification, and antibiotic susceptibility testing of Mycobacterium tuberculosis in Mexico // J Clin Microbiol. - 2001. - Vol. 39, № 11. - Р. 3883-3888. DOI: 10.1128/JCM.39.11.3883-3888.2001
5. Carrière C., Riska P.F., Zimhony O., Kriakov J., Bardarov S., Burns J., Chan J., Jacobs W.R. Jr. Conditionally replicating luciferase reporter phages: improved sensitivity for rapid detection and assessment of drug susceptibility of Mycobacterium tuberculosis // J Clin Microbiol. - 1997. - Vol. 35, № 12. - Р. 3232-3239. DOI: 10.1128/jcm.35.12.3232-3239.1997
6. Dusthackeer A., Kumar V., Subbian S., Sivaramakrishnan G., Zhu G., Subramanyam B., Hassan S., Nagamaiah S., Chan J., Paranji Rama N. Construction and evaluation of luciferase reporter phages for the detection of active and non-replicating tubercle bacilli // J Microbiol Methods. - 2008. - Vol. 73, № 1. - Р. 18-25. DOI: 10.1016/j.mimet.2008.01.005
7. Froman S., Will D.W., Bogen E. Bacteriophage active against virulent Mycobacterium tuberculosis. I. Isolation and activity // Am J Public Health Nations Health. - 1954. - Vol. 44, № 10. - Р. 1326-1333. DOI: 10.2105/ajph.44.10.1326
8. Hatfull G.F. Molecular Genetics of Mycobacteriophages // Microbiol Spectr. - 2014. - Vol. 2, № 2. - Р.1-36 10.1128/microbiolspec. MGM2-0032-2013. DOI: 10.1128/microbiolspec.MGM2-0032-2013
9. Hatfull G.F. Mycobacteriophages: Genes and genomes // Annu Rev Microbiol. - 2010. - № 64. - Р. 331-356. DOI: 10.1146/annurev.micro.112408.134233
10. Hatfull G.F. Mycobacteriophages: windows into tuberculosis // PLoS Pathog. - 2014. - Vol. 10, № 3. - Р. e1003953. DOI: 10.1371/journal.ppat.1003953
11. Hatfull G.F. The Secret Lives of Mycobacteriophages // Adv Virus Res. - 2012. - № 82. - Р. 179-288. DOI: 10.1016/B978-0-12-394621-8.00015-7
12. Hosseiniporgham S., Sechi L.A. A Review on Mycobacteriophages: From Classification to Applications // Pathogens. -2022. - Vol. 11, № 7. - Р. 777. DOI: 10.3390/pathogens11070777
13. Jacobs W.R. Jr., Barletta R.G., Udani R., Chan J., Kalkut G., Sosne G., Kieser T., Sarkis G.J., Hatfull G.F., Bloom B.R. Rapid assessment of drug susceptibilities of Mycobacterium tuberculosis by means of luciferase reporter phages // Science. - 1993. - Vol. 260, № 5109. - Р. 819-822. DOI: 10.1126/science.8484123
14. Kisa O., Albay A., Bedir O., Baylan O., Doganci L. Evaluation of FASTPlaqueTB-RIF for determination of rifampicin resistance in Mycobacterium tuberculosis complex isolates // Int J Tuberc Lung Dis. - 2003. - Vol. 7, № 3. - Р. 284-288.
15. Marei A.M., El-Behedy E.M., Mohtady H.A., Afify A.F. Evaluation of a rapid bacteriophage-based method for the detection of Mycobacterium tuberculosis in clinical samples // J. Med. Microbiol. -2003. - Vol. 52, № Pt 4. - Р. 331-335. DOI: 10.1099/jmm.0.05091-0
16. McNerney R., Kambashi B.S., Kinkese J., Tembwe R., Godfrey-Faussett P. Development of a bacteriophage phage replication assay for diagnosis of pulmonary tuberculosis // J Clin Microbiol. -2004. - Vol. 42, № 5. - Р. 2115-2120. DOI: 10.1128/JCM.42.5.2115-2120.2004
17. McNerney R., Wilson S.M., Sidhu A.M., et al. Inactivation of mycobacteriophage D29 using ferrous ammonium sulphate as tool for the detection of viabl Mycobacterium smegmatis and M. tuberculosis // Res Microbiol. - 1998. - Vol. 149, № 7. - Р. 487-495. DOI: 10.1016/s0923-2508(98)80003-x
18. Pearson R.E., Jurgensen S., Sarkis G.J., Hatfull G.F., Jacobs W.R. Jr. Construction of D29 shuttle phasmids and luciferase reporter phages for detection of mycobacteria // Gene. - 1996. - Vol. 183, № 1-2. - Р. 129-136. DOI: 10.1016/s0378-1119(96)00530-6
19. Pholwat S., Ehdaie B., Foongladda S., Kelly K., Houpt E. Real-time PCR using mycobacteriophage DNA for rapid phenotypic drug susceptibility results for Mycobacterium tuberculosis // J Clin Microbiol. - 2012. - Vol. 50, № 3. - Р. 754-761. DOI: 10.1128/JCM.01315-11
20. Piuri M., Jacobs W.R. Jr., Hatfull G.F. Fluoromycobacteriophages for rapid, specific, and sensitive antibiotic susceptibility testing of Mycobacterium tuberculosis // PLoS One. - 2009. - Vol. 4, № 3. -Р. e4870. DOI: 10.1371/journal.pone.0004870
21. Pope W.H., Jacobs-Sera D., Russell D.A., Peebles C.L., Al-Atrache Z., Alcoser T.A., Alexander L. M., Alfano M.B., Alford S.T., Amy N.E., Anderson M.D., Anderson A.G., et al. Expanding the diversity of mycobacteriophages: Insights into genome architecture and evolution // PLoS One. -2011. - Vol. 6, № 1. - Р. e16329. DOI: 10.1371/journal.pone.0016329
22. Sarkis G.J., Jacobs W.R. Jr., Hatfull G.F. L5 luciferase reporter mycobacteriophages: a sensitive tool for the detection and assay of live mycobacteria // Mol Microbiol. - 1995. - Vol. 15, № 6. - Р.1055-67. DOI: 10.1111/j.1365-2958.1995.tb02281.x
23. Símboli N., Takiff H., McNerney R., López B., Martin A., Palomino J. C., et al. In-house phage amplification assay is a sound alternative for detecting rifampin-resistant Mycobacterium tuberculosis in low-resource settings // Antimicrob. Agents Chemother. - 2005. - Vol. 49, № 1. - Р. 425-427. DOI: 10.1128/AAC.49.1.425-427.2005
24. The Actinobacteriophage Database at PhagesDB.org. Available at: http://phagesdb.org.
25. Urdániz E., Rondón L., Martí M.A., Hatfull G.F., Piuri M. Rapid Whole-Cell Assay of Antitubercular Drugs Using Second-Generation Fluoromycobacteriophages // Antimicrob. Agents Chemother. -2016. - Vol. 60, № 5. - Р. 3253-3256. DOI: 10.1128/AAC.03016-15
26. Wilson S.M., al-Suwaidi Z., McNerney R., Porter J., Drobniewski F. Evaluation of a new rapid bacteriophage-based method for the drug susceptibility testing of Mycobacterium tuberculosis // Nat Med. -1997. - Vol. 3, № 4. - Р. 465-468. DOI: 10.1038/nm0497-465
27. Xiao Y.X., Liu K.H., Lin W.H., Chan T.H. Whole-genome sequencing-based analyses of drug-resistant Mycobacterium tuberculosis from Taiwan // Sci Rep. - 2023. - Vol. 13, № 1. - Р. 2540.
Выпуск
Другие статьи выпуска
Фармакогенетическое тестирование – наиболее перспективный инструмент персонализированной медицины, направленный на повышение эффективности и безопасности лечения, особенно у сложных коморбидных пациентов. Проведен анализ 122 публикаций, посвященных теоретическим и прикладным аспектам применения фармакогенетического тестирования при лечении больных туберкулезом. Рассмотрена роль генетических полиморфизмов в ответе на лечение, представлены данные о белках, участвующих в процессах фармакокинетики и фармакодинамики основных противотуберкулезных препаратов, и кодирующих эти белки генах. Проанализирован перечень наиболее значимых маркеров, связанных с риском нежелательных реакций при лечении лекарственно-чувствительного и лекарственно-устойчивого туберкулеза, охарактеризованы перспективы их применения в клинической практике. В списке литературы отражены 56 ключевых публикаций, на которые имеются ссылки в тексте.
Одним из перспективных направлений в диагностике туберкулеза являются трегалозные зонды, способные селективно проникать в Mycobacterium tuberculosis (МБT). При этом зонды генерируют флуоресцентный сигнал, позволяя проводить таким образцом детекцию. Для анализа современного состояния и перспектив применения трегалозных зондов, как нового подхода к экспресс-диагностике Mycobacterium tuberculosis, проведен обзор научной литературы. Рассмотрены основные типы зондов: флуорогенные, построенные по схеме «флуорофор-тушитель» и фотоактивируемые. Трегалозные зонды обеспечивают селективную детекцию МБT за счет специфического поглощения трегалозы, встраивания в клеточную стенку и последующей активации флуоресценции. Зонды позволяют обнаруживать МБT в образцах мокроты без сложной пробоподготовки и этапов отмывки. Методика позволяет дифференцировать жизнеспособные и нежизнеспособные клетки МБT, а также может применяться для тестирования их лекарственной чувствительности.
Туберкулез женских половых органов – болезнь преимущественно репродуктивного возраста, реже заболевание развивается у женщин в постменопаузе. Приведен клинический случай диагностики туберкулеза половых органов у женщины 72 лет. У нее ультразвуковое исследование живота выявило серозометру и жидкостные образования в правом яичнике. Гистологическое исследование соскоба стенок и шейки матки диагностической информации не дало. При лапароскопии обнаружили выраженные спайки и инкапсулированный очаг. Гистологическое исследование операционного материала подтвердило туберкулез.
Представлен клинический случай успешного лечения у пациентки 13 лет посттуберкулезного стеноза левого главного бронха 3-4 степени с помощью самофиксирующегося эндопротеза. В результате химиотерапии туберкулеза продолжительностью 24 месяца, и эндопротезирования продолжительностью 18 месяцев удалось вылечить туберкулез легких и бронхов, восстановить функцию ЛГБ, избежать органоуносящей операции у ребенка. Метод лечения с помощью самофиксирующихся эндопротезов во фтизиатрической детской практике применен впервые.
Цель исследования: изучить у больных ВИЧ-инфекцией функциональные исходы экстраплевральной торакопластики по поводу деструктивного туберкулеза через 6 месяцев после операции.
Материалы и методы. Ретроспективно было сформированы две группы пациентов, перенесших экстраплевральную торакопластику (ЭПТ) по поводу деструктивного туберкулеза легких: в основную группу (ОГ) вошли 49 пациентов с ВИЧ-инфекцией, в группу сравнения (ГС) были выбраны 49 пациентов без ВИЧ-инфекции, сопоставимые с ОГ по возрасту, полу, распространенности туберкулеза легких. У пациентов обеих групп были оценены следующие показатели: динамика одышки, жизненная емкость легких (ЖЕЛ), объем форсированного выдоха за первую секунду (ОФВ1), индекс Тиффно, показатели капиллярного легочного кровотока (КЛК).
Результаты. В группе ОГ операция экстраплевральной торакопластики способствовала ликвидации полости деструкции к сроку 6 месяцев у 30,6% (15/49 пациентов), прекращению бактериовыделения у 46,9% (23/49 пациентов). Эти показатели значимо не отличались от таковых у пациентов группы сравнения (с ВИЧ-отрицательным статусом). Ухудшение результатов спирометрии зафиксировано у 28,3±14,6% пациентов в ОГ и у 29,5±14,6% в ГС, p>0,05; КЛК сохранялся на дооперационном уровне в обеих группах. У 14 (28,6%) больных ОГ при недостаточном эффекте ЭПТ (сохранение полостей распада и бактериовыделения) выявлено существенное уменьшение степени одышки после операции без значимых изменений дооперационных показателей спирометрии. Это позволяет считать операцию ЭПТ безопасной в функциональном отношении.
Цель исследования: оценка применения двухэтапного эндопротезирования при лечении деструктивной формы септического гонита туберкулезной и неспецифической этиологии, включая ВИЧ-позитивных пациентов.
Материалы и методы. В исследование вошли 15 пациентов с деструктивной формой септического гонита как неспецифической или/и туберкулезной этиологии, которым проводилось хирургическое лечение. У 7/15 (46,67%) пациентов была туберкулезная этиология заболевания, у 8 (53,33%) – неспецифическая, ВИЧ-позитивный статус имели 5/15 (33,33%) пациентов. У пациентов планировалось двухэтапное эндопротезирование с использованием цементных артикулирующих спейсеров, насыщенных антимикробными препаратами по лекарственной чувствительности возбудителя. У 10 пациентов (66,67%) выполнен полный цикл двухэтапного эндопротезирования, в 5 случаях (33,33%) – только первый этап.
Результаты. Во всех 15 случаях у пациентов получена стойкая эрадикация инфекции. У 10 пациентов, закончивших весь цикл хирургического лечения, по шкале KSS получено статистически значимое улучшение показателей с 35,4 ± 15,4 до 78,2 ± 15,1 (p<0,05), сроки наблюдения – от 1 года до 14 лет. Не отмечено значимого влияния ВИЧ-инфекции на полученные результаты лечения.
Цель исследования: сравнительная оценка гепатотоксичности комбинаций противотуберкулезных препаратов (ПТП), в том числе рекомендуемых для коротких курсов химиотерапии, анализ протекторных свойств семакса и аскорбигена.
Материалы и методы. Исследование состояло из 2-х экспериментов, которые различались по комбинации ПТП и препарату сопровождения. В 1-м эксперименте крысы опытных групп получали Mxf Lzd Pto Cs Z и Mxf Lzd Pto Cs Z + семакс; во 2-м эксперименте – Mxf Lzd Pto Bdq Cfz и Mxf Lzd Pto Bdq Cfz + аскорбиген. Крысы контрольных групп получали перорально 1%-ный крахмальный гель. Длительность введения составила 14 дней во всех группах. Гепатотоксичность оценивали по биохимическим показателям и патоморфологическим критериям.
Результаты. У крыс, получавших Mxf Lzd Pto Cs Z, определяли статистически значимое повышение активности трансаминаз и содержания общего билирубина, выраженные изменения ткани печени по сравнению с контрольной группой. У крыс, получавших Mxf Lzd Pto Bdq Cfz, на фоне повышения активности трансаминаз патоморфологические изменения печени были менее выражены. Применение семакса и аскорбигена способствовало нормализации ферментативной активности и снижению повреждения ткани печени. Показано, что токсикомодифицирующие свойства аскорбигена более выражены, однако гепатопротекторный потенциал семакса проявился при более глубоких структурных нарушениях печени.
Цель исследования: изучить факторы, влияющие на результаты лечения у впервые выявленных больных туберкулезом из коренных малочисленных народов Севера (КМНС), проживающих в Ямало-Ненецком автономном округе (ЯНАО).
Материалы и методы. Проведено ретроспективное когортное исследование результатов лечения впервые выявленных пациентов, зарегистрированных для лечения по режимам лекарственно-чувствительного туберкулеза в ЯНАО за 2010- 2022 гг. Выполнен факторный анализ предикторов неблагоприятного исхода химиотерапии у пациентов из числа КМНС.
Результаты. Среди пациентов из числа КМНС отмечается более низкая частота успешного лечения (58,79%) туберкулеза, чем среди некоренных постоянных жителей ЯНАО (68,45%; p=0,001) за счет высокой частоты последующего выявления лекарственной устойчивости возбудителя и перевода на соответствующий режим лечения (p<0,0001), высокой частоты неудач курса химиотерапии (p=0,001) у ряда пациентов, ассоциированной с наличием алкогольной зависимости (ОШ=2,80; p=0,045), позднего выявления туберкулеза (p=0,01). Для данной категории населения целесообразно обсудить ежегодную частоту флюорографического обследования на туберкулез.
Цель исследования: оценить эффективность и безопасность применения рекомбинантного интерферона гамма в комплексной терапии туберкулеза легких с лекарственной устойчивостью.
Материалы и методы. В исследование включено 84 пациента с лекарственно-устойчивым туберкулезом, путем рандомизации они разделены поровну на две группы: основную группу (ОГ) и контрольную (КГ). Пациенты обеих групп получали противотуберкулезную химиотерапию в соответствии с индивидуальной лекарственной чувствительностью микобактерий туберкулеза (МБТ). Пациенты ОГ дополнительно получали рекомбинантного интерферона гамма (рИФН-γ) (внутримышечно, в дозе 500 000 МЕ 1 раз в сутки ежедневно в течение 3 месяцев). Общий период наблюдения за пациентами составил 6 месяцев.
Результаты. В процессе лечения у пациентов обеих групп наблюдалось уменьшение клинических проявлений туберкулеза, но в ОГ это происходило быстрее. Прекращение бактериовыделения в ОГ зафиксировано в среднем через 18,6 дней лечения (микроскопия) и 16,8 дней (культуральное исследование) против 28,8 дней и 25,5 дней соответственно в КГ (p<0,05). Ко 2-му месяцу лечения положительная рентгенологическая динамика установлена у 83,3% пациентов ОГ против 30,0% в КГ (р <0,05. Через 6 месяцев лечения достигнуто рассасывание инфильтрации и очагов в легких у 92,9% пациентов в ОГ против 61,9% в КГ (р<0,05). За весь период наблюдения нежелательные явления (НЯ) зарегистрированы у 23 (54,8%) пациентов ОГ и у 17 (40,5%) пациентов КГ (р>0,05). Всего отмечены 87 НЯ: у 48 пациентов ОГ и у 39 – в КГ. У большинства пациентов встречалось по 1-2 НЯ. Наиболее часто среди НЯ встречались отклонения от нормы в лабораторных показателях. У всех пациентов ОГ переносимость препарата рИФН-γ оценивалась как отличная. Исследование показало, что применение рИФН-γ в виде 3-месячного курса дополнительно к противотуберкулезной химиотерапии может сократить сроки и улучшить эффективность лечения больных лекарственно-устойчивым туберкулезом.
Цель исследования: определить ранние факторы неблагоприятного течения сочетания ВИЧ-инфекции и туберкулеза для совершенствования подходов к лечению таких пациентов.
Материалы и методы. В исследование включено 105 пациентов с ВИЧ-инфекцией, у которых впервые выявлен туберкулез и обнаружены в биологическом материале ДНК М. tuberculosis (МБТ) молекулярно-генетическим методом. Пациенты разделены на две группы: с благоприятным течением сочетания ВИЧ-инфекции и ТБ (78 человек) и неблагоприятным течением (27 человек).
Результаты. Определены значимые факторы, влияющие на течение сочетания ВИЧ-инфекции и ТБ и легкодоступные у каждого пациента (уровни лейкоцитов (х), гемоглобина (у), альбумина (z), железа (w). Была построена дискриминантная модель, представляющая формулу D= -8,263-0,110x+0,012y+0,197z+0,024w. Точность модели 83,3%. Если полученный показатель D ≥ -0,301, то пациент имеет низкий риск неблагоприятного течения сочетанного заболевания, в случае D< -0,301, пациент имеет высокий риск неблагоприятного течения сочетанного заболевания ВИЧ-инфекции и туберкулеза. При неблагоприятном прогнозе выполнение расширенного молекулярно-генетического анализа лекарственной устойчивости МБТ позволит подобрать актуальную схему лечения ТБ. При отсутствии данных по МБТ следует использовать режимы лечения лекарственно-устойчивого туберкулеза.
Цель исследования: оценка возможности современных методов тестирования устойчивости к рифампицину в выявлении гетерорезистентности культур Mycobacterium tuberculosis.
Материалы и методы. Искусственно созданы смеси чувствительного (H37Rv) и устойчивого (штамм 5521 с ШЛУ, с мутацией rpoB Ser531Leu) штаммов МБТ в пропорциях от 0% до 100%. Для тестирования устойчивости к рифампицину использованы фенотипические методы (BACTEC MGIT 960, метод пропорций на среде Миддлбрук 7H10) и молекулярно-генетические тесты (ТБ-ТЕСТ, Амплитуб-МЛУ-РВ, АмплиТест МБТ-Резист I).
Результаты. Фенотипические методы выявили устойчивость к рифампицину при 1% резистентных клеток в смеси. Молекулярно-генетические методы показали вариабельный порог детекции: 5% (АмплиТест МБТ-Резист I), 20% (ТБ-ТЕСТ), 30% (Амплитуб-МЛУ-РВ). Показана возможность повышения чувствительности отечественных молекулярно-генетических тест-систем путем совершенствования программ интерпретации данных ПЦР, а также необходимость разработки алгоритмов диагностики ЛЧ МБТ с учетом ограничений используемых методов.
Цель исследования: сравнить эффективность и безопасность лечения туберкулеза с лекарственной чувствительностью при применении четырехмесячного и шестимесячного режимов химиотерапии.
Материалы и методы. В период с октября 2023 по август 2025 гг. проведено многоцентровое когортное исследование по лечению лекарственно-чувствительного туберкулеза с применением короткого (четырехмесячного) режима (группа КР) химиотерапии (ХТ) по схеме: рифапентин (900 мг в сутки), изониазид, пиразинамид, левофлоксацин в интенсивной фазе в течение двух месяцев и рифапентин (900 мг в сутки), изониазид и пиразинамид в фазе продолжения. Группу сравнения (СР) составили пациенты, получавшие в этот период шестимесячный режим ХТ лекарственно-чувствительного туберкулеза. Результаты эффективности оценивались по прекращению бактериовыделения и клинико-рентгенологической динамике.
Результаты. Эффективный результат лечения достигнут у 92,0% (46/50) пациентов в группе КР против 76,6% (46/60) в группе СР (p=0,038). Прекращение бактериовыделения по микроскопии к концу ХТ зарегистрировано у 96,0% (48/50) и 76,7% (46/60) соответственно (p=0,005); культурально – у 94,0% (47/50) и у 73,3% (44/60) (p=0,004). Общая частота нежелательных реакций была ниже в группе КР (57,7%) против 74,6% в группе СР, p=0,045.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- РОФ
- Регион
- Россия, Москва
- Почтовый адрес
- 127473, г Москва, р-н Марьина роща, ул Достоевского, д 4
- Юр. адрес
- 127473, г Москва, р-н Марьина роща, ул Достоевского, д 4
- ФИО
- Васильева Ирина Анатольевна (ПРЕЗИДЕНТ)
- Контактный телефон
- +7 (___) _______
- Сайт
- https://rof-tb.ru/