Введение. В настоящее время наблюдается широкое распространение и активная циркуляция Mycoplasma dispar в животноводческих хозяйствах по всему миру, в том числе и в Российской Федерации. Актуальность внедрения в ветеринарную практику тест-системы на основе полимеразной цепной реакции в режиме реального времени для выявления ДНК Mycoplasma dispar обусловлена важной ролью данного возбудителя в развитии комплекса респираторных болезней крупного рогатого скота, приводящих к значительным экономическим потерям в животноводстве, в том числе являющихся причиной падежа телят.
Цель исследования. Определение основных валидационных характеристик и внедрение в ветеринарную практику разработанной тест-системы для выявления ДНК Mycoplasma dispar методом полимеразной цепной реакции в режиме реального времени.
Материалы и методы. Референтный штамм Mycoplasma dispar (ATCC № 27140) культивировали на питательной среде 1699 Revised Mycoplasma Medium, рекомендованной American Type Culture Collection. ДНК выделяли с использованием коммерческого набора, постановка ПЦР в режиме реального времени осуществлялась по заранее подобранным параметрам. Были определены основные валидационные характеристики тест-системы: аналитическая чувствительность, аналитическая специфичность, эффективность амплификации, повторяемость и воспроизводимость. Показана возможность практического применения тест-системы на основе ПЦР в режиме реального времени для выявления ДНК Mycoplasma dispar.
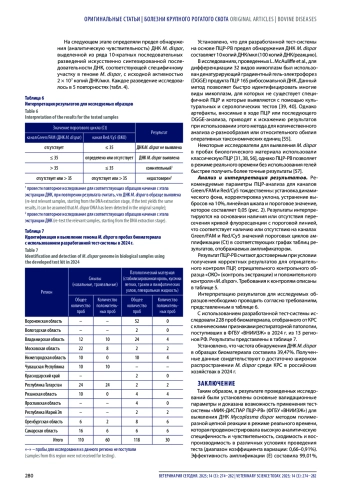
Результаты. Аналитическая чувствительность (предел обнаружения) тест-системы по выявлению ДНК Mycoplasma dispar составила 10 копий ДНК/мкл (или 100 копий ДНК/реакцию), специфичность – 100% (детектирует только ДНК Mycoplasma dispar), эффективность амплификации – 99,01%, среднее значение коэффициента вариации при оценке повторяемости – 0,91%, воспроизводимости – 0,66–1,26% в рамках 5 повторений и 0,91% в рамках 15 повторений. Апробацию тест-системы проводили на 228 пробах биоматериала, отобранных от крупного рогатого скота из 13 регионов Российской Федерации, при этом ДНК Mycoplasma dispar была обнаружена в 39,47% исследуемых проб.
Заключение. Разработанная тест-система для выявления ДНК Mycoplasma dispar продемонстрировала высокие валидационные показатели и может быть использована в диагностике микоплазмоза крупного рогатого скота.
Идентификаторы и классификаторы
- SCI
- Биология
Mycoplasma dispar является одним из возбудителей респираторных заболеваний крупного рогатого скота (КРС), в том числе телят, и имеет повсеместное распространение. Болезнь, вызванная M. dispar, характеризуется воспалением слизистых оболочек верхних дыхательных путей и поражением легких, что приводит к значительным убыткам в животноводстве [1, 2, 3].
Список литературы
1. Tortorelli G., Carrillo Gaeta N., Mendonga Ribeiro B. L., Miranda Marques L., Timenetsky J., Gregory L. Evaluation of Mollicutes microorganisms in respiratory disease of cattle and their relationship to clinical signs. Journal of Veterinary Internal Medicine. 2017; 31 (4): 1215-1220. DOI: 10.1111/jvim.14721
2. Chen S., Hao H., Yan X., Liu Y, Chu Y. Genomewide analysis of Mycoplasma dispar provides insights into putative virulence factors and phylogenetic relationships. G3: Genes, Genomes, Genetics. 2019; 9 (2): 317-325. DOI: 10.1534/g3.118.200941
3. Абед Алхуссен М., Кирпиченко В. В., Яцентюк С. П., Нестеров А. А., Бьядовская О. П., Жбанова Т. В., Спрыгин А. В. Патогенные микоплазмы крупного рогатого скота Mycoplasma bovis, M. bovigenitalium и M. dispar, краткая характеристика возбудителей (обзор). Сельскохозяйственная биология. 2021; 56 (2): 245-260. DOI: 10.15389/agrobiology.2021.2.245rus
Abed Alhussen M., Kirpichenko V. V., Yatsentyuk S. P., Nesterov A. A., Byadovskaya O. P., Zhbanova T. V., Sprygin A. V. Mycoplasma bovis, M. bovigenitalium and M. dispar as bovine pathogens: brief characteristics of the pathogens (review). Agricultural Biology. 2021; 56 (2): 245-260. DOI: 10.15389/agrobiology.2021.2.245eng
4. Herrmann R. Genome structure and organization. In: Mycoplasmas: Molecular Biology and Pathogenesis. Ed. by J. Maniloff. Washington: American Society for Microbiology; 1992; 157-168.
5. Ter Laak E. A., Noordergraaf J. H. An improved method for the identification of Mycoplasma dispar. Veterinary Microbiology. 1987; 14 (1): 25-31. DOI: 10.1016/0378-1135(87)90049-6
6. Nicholas R. A. J., Khan L. A., Houshaymi B., Miles R. J., Ayling R. D., Hotzel H., Sachse K. Close genetic and phenotypic relatedness between Mycoplasma ovine/caprine serogroup 11 and Mycoplasma bovigenitalium. Systematic and Applied Microbiology. 2002; 25 (3): 396-402. DOI: 10.1078/0723-2020-00121
7. Ter Laak E. A., Noordergraaf J. H., Dieltjes R. P. J. W. Prevalence of mycoplasmas in the respiratory tracts of pneumonic calves. Journal of Veterinary Medicine, Series B. 1992; 39 (1-10): 553-562. DOI: 10.1111/j.1439-0450.1992.tb01205.x
8. Nicholas R., Ayling R., McAuliffe L. Mycoplasma diseases of ruminants. Wallingford: CABI; 2008. 239 p. DOI: 10.1079/9780851990125.0000
9. Almeida R. A., Rosenbusch R. F. Capsulelike surface material of Mycoplasma dispar induced by in vitro growth in culture with bovine cells is antigenically related to similar structures expressed in vivo. Infection and Immunity. 1991; 59 (9): 3119-3125. DOI: 10.1128/iai.59.9.3119-3125.1991
10. Howard C. J., Gourlay R. N., Taylor G. Immunity to Mycoplasma infections of the calf respiratory tract. Advances in Experimental Medicine and Biology. 1981; 137: 711-726. https://pubmed.ncbi.nlm.nih.gov/7331951.
11. Ayling R. D., Bashiruddin S. E., Nicholas R. A. J. Mycoplasma species and related organisms isolated from ruminants in Britain between 1990 and 2000. Veterinary Record. 2004; 155 (14): 413-416. DOI: 10.1136/vr.155.14.413
12. Franga Dias de Oliveira B. A., Carrillo Gaeta N., Mendonga Ribeiro B. L., Reyes Aleman M. A., Miranda Marques L., Timenetsky J., et al. Determination of bacterial aetiologic factor on tracheobronchial lavage in relation to clinical signs of bovine respiratory disease. Journal of Medical Microbiology. 2016; 65 (10): 1137-1142. DOI: 10.1099/jmm.0.000345
13. Bottinelli M., Passamonti F., Rampacci E., Stefanetti V., Pochiero L., Coletti M., et al. DNA microarray assay and real-time PCR as useful tools for studying the respiratory tract Mycoplasma populations in young dairy calves. Journal of Medical Microbiology. 2017; 66 (9): 1342-1349. DOI: 10.1099/jmm.0.000571
14. Mosier D. Review of BRD pathogenesis: the old and the new. Animal Health Research Reviews. 2014; 15 (2): 166-168. DOI: 10.1017/S1466252314000176
15. Taylor G. Immunity to Mycoplasma infections of the respiratory tract: a review. Journal of the Royal Society of Medicine. 1979; 72 (7): 520-526. DOI: 10.1177/014107687907200711
16. Абед Алхуссен М., Нестеров А. А., Кирпиченко В. В., Яцентюк С. П., Спрыгин А. В., Бьядовская О. П., Кононов А. В. Распространение микоплазмозов крупного рогатого скота на животноводческих фермах в Российской Федерации в период с 2015 по 2018 год. Ветеринария сегодня. 2020; (2): 102-108. DOI: 10.29326/2304-196X-2020-2-33-102-108
Abed Alhussen M., Nesterov A. А., Kirpichenko V. V., Yatsentyuk S. P, Sprygin A. V., Byadovskaya O. P., Kononov A. V. Bovine mycoplasmosis occurrence on livestock farms in the Russian Federation for 2015-2018. Veterinary Science Today. 2020; (2): 102-108. DOI: 10.29326/2304-196X-2020-2-33-102-108
17. Bernier Gosselin V., Francoz D., Babkine M., Desrochers A., Nichols S., Dore E, et al. A retrospective study of 29 cases of otitis media/interna in dairy calves. The Canadian Veterinary Journal. 2012; 53 (9): 957-962. https://pubmed.ncbi.nlm.nih.gov/23450859.
18. Parker A. M., Sheehy P. A., Hazelton M. S., Bosward K. L., House J. K. A review of Mycoplasma diagnostics in cattle. Journal of Veterinary Internal Medicine. 2018; 32 (3): 1241-1252. DOI: 10.1111/jvim.15135
19. Ter Laak E. A., Noordergraaf J. H., Verschure M. H. Susceptibilities of Mycoplasma bovis, Mycoplasma dispar, and Ureaplasma diversum strains to antimicrobial agents in vitro. Antimicrobial Agents and Chemotherapy. 1993; 37 (2): 317-321. DOI: 10.1128/AAC.37.2.317
20. Tegtmeier C., Uttenthal A. A., Friis N. F., Jensen N. E., Jensen H. E. Pathological and microbiological studies on pneumonic lungs from Danish calves. Journal of Veterinary Medicine, Series B. 1999; 46 (10): 693-700. https://doi.org/10.1046Zj.1439-0450.1999.00301.x.
21. Bottinelli M., Merenda M., Gastaldelli M., Picchi M., Stefani E., Nicholas R. A. J., Catania S. The pathogen Mycoplasma dispar shows high minimum inhibitory concentrations for antimicrobials commonly used for bovine respiratory disease. Antibiotics. 2020; 9 (8):460. DOI: 10.3390/antibiotics9080460
22. De Donder K. D., Apley M. D. A literature review of antimicrobial resistance in Pathogens associated with bovine respiratory disease. Animal Health Research Reviews. 2015; 16 (2): 125-134. DOI: 10.1017/S146625231500016X
23. Anholt R. M., Klima C., Allan N., Matheson-Bird H., Schatz C., Ajitkumar P., et al. Antimicrobial susceptibility of bacteria that cause bovine respiratory disease complex in Alberta, Canada. Frontiers in Veterinary Science. 2017; (4):207. DOI: 10.3389/FVETS.2017.00207
24. Dabo S. M., Taylor J. D., Confer A. W. Pasteurella multocida and bovine respiratory disease. Animal Health Research Reviews. 2007; 8 (2): 129-150. DOI: 10.1017/S1466252307001399
25. Almeida R. A., Wannemuehler M. J., Rosenbusch R. F.Interaction of Mycoplasma dispar with bovine alveolar macrophages. Infection and Immunity. 1992; 60 (7): 29142919. DOI: 10.1128/iai.60.7.2914-2919.1992
26. Friis N. F. Mycoplasma dispar as a causative agent in pneumonia of calves. Acta Veterinaria Scandinavica. 1980; 21: 34-42. DOI: 10.1186/bf03546898
27. Ross R. F. Mycoplasma - animal pathogens. In: Rapid Diagnosis of Mycoplasmas. Ed. by I. Kahane, A. Adoni. Boston: Springer; 1993; 69-109. DOI: 10.1007/978-1-4615-2478-6_7
28. Jasper D. E. Bovine mycoplasmal mastitis. Journal of the American Veterinary Medical Association. 1979; 175 (10): 1072-1074. DOI: 10.2460/javma.1979.175.10.1072
29. Gourlay R. N., Howard C. J., Thomas L. H., Wyld S. G. Pathogenicity of some Mycoplasma and Acholeplasma species in the lungs of gnotobiotic calves. Research in Veterinary Science. 1979; 27 (2): 233-237. DOI: 10.1016/S0034-5288(18)32836-4
30. George T. D., Horsfall N., Sullivan N. D. A subclinical pneumonia of calves associated with Mycoplasma dispar. Australian Veterinary Journal. 1973; 49 (12): 580-586. DOI: 10.1111/j.1751-0813.1973.tb06738.x
31. Shilan Faqe Muhammad Salih. Detection of Mycoplasma dispar in bovine respiratory disease by polymerase chain reaction assay in Sulaimaniyah city. Iraqi Journal of Agricultural Sciences. 2024; 55 (2): 703-710. DOI: 10.36103/p6042k98
32. Andersson A.-M., Aspan A., Wisselink H. J., Smid B., Ridley A., Pelkonen S., et al. A European inter-laboratory trial to evaluate the performance of three serological methods for diagnosis of Mycoplasma bovis infection in cattle using latent class analysis. BMC Veterinary Research. 2019; 15:369. DOI: 10.1186/s12917-019-2117-0
33. Dudek K., Nicholas R. A. J., Szacawa E., Bednarek D. Mycoplasma bovis infections -occurrence, diagnosis and control. Pathogens. 2020; 9 (8):640. DOI: 10.3390/pathogens9080640
34. Абед Алхуссен М. Молекулярно-биологические методы диагностики микоплазмозов крупного рогатого скота: дис.. канд. вет. наук. Владимир: ФГБУ “ВНИИЗЖ”; 2023. 194 с. Abed Alhussen M. Molecular and biological methods for bovine mycoplasmosis diagnostics: Author’s thesis for degree of Cand. Sci. (Veterinary Medicine). Vladimir: Federal Centre for Animal Health; 2023. 194 p. (in Russ.).
35. Howard C. J. Mycoplasmas and bovine respiratory disease: studies related to pathogenicity and the immune response - a selective review. Yale Journal of Biology and Medicine. 1983; 56 (5-6): 789-797. https://pubmed.ncbi.nlm.nih.gov/6382831.
36. Martin S. W., Bateman K. G., Shewen P E., Rosendal S., Bohac J. E. The frequency, distribution and effects of antibodies, to seven putative respiratory pathogens, on respiratory disease and weight gain in feedlot calves in Ontario. Canadian Journal of Veterinary Research. 1989; 53 (3): 355-362. https://pubmed.ncbi.nlm.nih.gov/2766158.
37. Martin S. W., Bateman K. G., Shewen P. E., Rosendal S., Bohac J. G., Thorburn M. A group level analysis of the associations between antibodies to seven putative pathogens and respiratory disease and weight gain in Ontario feedlot calves. Canadian Journal of Veterinary Research. 1990; 54 (3): 337-342. https://pubmed.ncbi.nlm.nih.gov/2165846.
38. Miles K., McAuliffe L., Ayling R. D., Nicholas R. A. J. Rapid detection of Mycoplasma dispar and M. bovirhinis using allele specific polymerase chain reaction protocols. FEMS Microbiology Letters. 2004; 241 (1): 103-107. DOI: 10.1016/j.femsle.2004.10.010
39. McAuliffe L., Ellis R. J., Lawes J. R., Ayling R. D., Nicholas R. A. J. 16S rDNA PCR and denaturing gradient gel electrophoresis; a single generic test for detecting and differentiating Mycoplasma species. Journal of Medical Microbiology. 2005; 54 (8): 731 -739. DOI: 10.1099/jmm.0.46058-0
40. McAuliffe L., Ellis R. J., Ayling R. D., Nicholas R. A. J. Differentiation of Mycoplasma species by 16S ribosomal DNA PCR and denaturing gradient gel electrophoresis fingerprinting. Journal of Clinical Microbiology. 2003; 41 (10): 4844-4847. DOI: 10.1128/JCM.41.10.4844-4847.2003
41. Baird S. C., Carman J., Dinsmore R. P., Walker R. L., Collins J. K. Detection and identification of Mycoplasma from bovine mastitis infections using a nested polymerase chain reaction. Journal of Veterinary Diagnostic Investigation. 1999; 11 (5): 432-435. DOI: 10.1177/104063879901100507
42. Moalic P.-Y., Gesbert F., Kempf I. Utility of an internal control for evaluation of a Mycoplasma meleagridis PCR test. Veterinary Microbiology. 1998; 61 (1-2): 41-49. DOI: 10.1016/S0378-1135(98)00173-4
43. Maaroufi Y., de Bruyne J.-M., Duchateau V., Scheen R., Crokaert F. Development of a multiple internal control for clinical diagnostic real-time amplification assays. FEMS Immunology and Medical Microbiology. 2006; 48 (2): 183-191. DOI: 10.1111/j.1574-695X.2006.00125.x
44. Hymas W., Stevenson J., Taggart E. W., Hillyard D. Use of lyophilized standards for the calibration of a newly developed real time PCR assay for human herpes type six (HHV6) variants A and B. Journal of Virological Methods. 2005; 128 (1-2): 143-150. DOI: 10.1016/j.jviromet.2005.05.003
45. Dingle K. E., Crook D., Jeffery K. Stable and noncompetitive RNA internal control for routine clinical diagnostic reverse transcription-PCR. Journal of Clinical Microbiology. 2004; 42 (3): 1003-1011. DOI: 10.1128/JCM.423.1003-1011.2004
46. Stocher M., Leb V., Berg J. A convenient approach to the generation of multiple internal control DNA for a panel of real-time PCR assays. Journal of Virological Methods. 2003; 108 (1): 1-8. DOI: 10.1016/S0166-0934(02)00266-5
47. OIE Quality Standard and Guidelines for Veterinary Laboratories: Infectious Diseases. 2nd ed. 2008. 70 p.
48. Frey J., Nicolet J. Molecular identification and epidemiology of animal myco-plasmas. Wiener Klinische Wochenschrift. 1997; 109 (14-15): 600-603. https://pubmed.ncbi.nlm.nih.gov/9286067.
49. Абед Алхуссен М., Нестеров А. А., Спрыгин А. В., Шумилова И. Н., Брянцева М. С., Бьядовская О. П. Оптимизация состава питательной среды и изучение стадий роста изолята “Калуга 2020” Mycoplasma bovis. Ветеринария сегодня. 2022; 11 (3): 262-267. DOI: 10.29326/2304-196X-2022-11-3-262-267
Abed Alhussen M., Nesterov А. А., Sprygin А. V., Shumilova I. N., Bryantseva M. S., Byadovskaya О. P. Optimization of medium composition and study of growth stages of Mycoplasma bovis “Kaluga 2020”isolate. Veterinary Science Today. 2022; 11 (3): 262-267. DOI: 10.29326/2304-196X-2022-11-3-262-267
50. Hwang M.-H., Damte D., Cho M.-H., Kim Y.-H., Park S.-C. Optimization of culture media of pathogenic Mycoplasma hyopneumoniae by a response surface methodology. Journal of Veterinary Science. 2010; 11 (4): 327-332. DOI: 10.4142/jvs.2010.11.4327
51. Морозова Е. О., Кротова А. О., Садчикова А. С., Тенитилов Н. А., Бьядовская О. П., Иголкин А. С. и др. Методические рекомендации по получению экзогенного внутреннего контрольного образца для ПЦР в режиме реального времени при выявлении ДНК микроорганизмов: утв. ФГБУ “ВНИИЗЖ” 13.10.2023 № 81-23. Владимир: ФГБУ “ВНИИЗЖ”; 2023. 32 с.
Morozova E. O., Krotova A. O., Sadchikova A. S., Tenitilov N. A., Byadovskaya O. P., Igolkin A. S., et al. Methodical recommendations on preparation of exogenous internal control sample for real-time PCR to detect microorganism DNA: approved by the Federal Centre for Animal Health 13.10.2023 No. 81-23. Vladimir: Federal Centre for Animal Health; 2023. 32 p. (in Russ.).
52. Bustin S. A., Benes V., Garson J. A., Hellemans J., Huggett J., Kubista M., et al. The MIQE guidelines: minimum information for publication of quantitative real-time PCR experiments. Clinical Chemistry. 2009; 55 (4): 611-622.
53. Yan L., Toohey-Kurth K. L., Crossley B. M., Bai J., Glaser A. L., Tallmadge R. L., Goodman L. B. Inhibition monitoring in veterinary molecular testing. Journal of Veterinary Diagnostic Investigation. 2020; 32 (6): 758-766. DOI: 10.1177/1040638719889315
54. Cornelissen J. B. W. J., de Bree F. M., van der Wal F. J., Kooi E. A., Koene M. G. J., Bossers A., et al. Mycoplasma detection by triplex real-time PCR in bronchoalveolar lavage fluid from bovine respiratory disease complex cases. BMC Veterinary Research. 2017; 13:97. DOI: 10.1186/s12917-017-1023-6 EDN: AADHXQ
55. Neilson J. W., Jordan F. L., Maier R. M. Analysis of artifacts suggests DGGE should not be used for quantitative diversity analysis. Journal of Microbiological Methods. 2013; 92 (3): 256-263. DOI: 10.1016/j.mimet.2012.12.021
56. Marques L. M., Buzinhani M., Yamaguti M., Oliveira R. C., Ferreira J. B., Mettifogo E., Timenetsky J. Use of a polymerase chain reaction for detection of Mycoplasma dispar in the nasal mucus of calves. Journal of Veterinary Diagnostic Investigation. 2007; 19 (1): 103-106. DOI: 10.1177/104063870701900118
57. Zhang G., Brown E. W., Gonzalez-Escalona N.Comparison of real-time PCR, reverse transcriptase real-time PCR, loop-mediated isothermal amplification, and the FDA conventional microbiological method for the detection of Salmonella spp. in produce. Applied and Environmental Microbiology. 2011; 77 (18): 6495-6501. DOI: 10.1128/AEM.00520-11
58. Deeney A. S., Collins R., Ridley A. M. Identification of Mycoplasma species and related organisms from ruminants in England and Wales during 2005-2019. BMC Veterinary Research. 2021; 17:325. DOI: 10.1186/s12917-021-03037-y
59. Chen J., Wang S., Dong D., Zhang Z., Huang Y., Zhang Y. Isolation and characterization of Mycoplasma ovipneumoniae infecting goats with pneumonia in Anhui Province, China. Life. 2024; 14 (2):218. DOI: 10.3390/life14020218
60. Wolfe L. L., Diamond B., Spraker T. R., Sirochman M. A., Walsh D. P, Machin C. M., et al. A bighorn sheep die-off in southern Colorado involving a Pasteurel-laceae strain that may have originated from syntopic cattle. Journal of Wildlife Diseases. 2010; 46 (4): 1262-1268.
Выпуск
Другие статьи выпуска
Введение. Несмотря на тот факт, что антибиотики – величайшее открытие человечества, они могут нанести огромный ущерб и привести к серьезным последствиям при нецелесообразном использовании.
Цель исследования. Исследование образцов животноводческой продукции с последующим выделением изолятов бактерий рода Salmonella, их типированием, определением и оценкой динамики развития антибиотикорезистентности.
Материалы и методы. Работу выполняли на базе отдела микробиологических исследований Владимирской испытательной лаборатории ФГБУ «ВНИИЗЖ». Для определения устойчивости бактерий к антибиотикам применяли диско-диффузионный метод. Значения зон задержки роста микроорганизмов интерпретировались согласно российским рекомендациям «Определение чувствительности микроорганизмов к антимикробным препаратам» (МАКМАХ, версия 2025-01), подготовленным на основе рекомендаций Европейского комитета по определению чувствительности к антимикробным препаратам (EUCAST) и с использованием стандарта CLSI M100. Серологическую идентификацию проводили с помощью моно- и поливалентных О- и Н-сывороток «ПЕТСАЛ»® (ФГУП СПбНИИВС ФМБА России). Гены антибиотикорезистентности (blaCTX-M, blaOXA10, blaDHA, blaGES, blaKPC, blaOXA48-like, blaNDM, blaVIM) определяли методом полимеразной цепной реакции в режиме реального времени с применением тест-систем серии «РЕЗИСТОМ» (ООО НПФ «Литех», Россия).
Результаты. При исследовании образцов продукции животного происхождения в 2022–2024 гг. выявлено 42 изолята бактерий рода Salmonella. Наиболее часто детектируемый изолят – S. Enteritidis, а превалирующий продукт, в котором обнаруживали бактерии рода Salmonella, – продукция из мяса птицы. Выявленные изоляты имели максимальную резистентность к бензилпенициллину, эритромицину, норфлоксацину и тетрациклину. Большинство из них проявили множественную устойчивость сразу к нескольким антимикробным препаратам. Отмечен рост резистентности к цефалоспоринам, фторхинолонам, тетрациклинам, аминогликозидам, хлорамфениколу/левомицетину и сульфаметоксазолу/триметоприму. При исследовании методом полимеразной цепной реакции в режиме реального времени гены антибиотикорезистентности не обнаружены.
Заключение. Показано значительное распространение устойчивости к антимикробным препаратам, в том числе множественной, среди изолятов бактерий рода Salmonella, выявленных в продукции животного происхождения в 2022–2024 гг.
Введение. Проведенная за последнее десятилетие перепись филогенетического разнообразия бактерий, колонизирующих кишечный тракт клинически здоровой птицы, показывает, что до 60% родóв, присутствующих в микробиоме кишечника, содержат спорообразующие бактерии, и эти роды составляют 30% от общей кишечной микробиоты. Были зарегистрированы преимущества, связанные с использованием пробиотиков, содержащих спорообразующие бактерии рода Bacillus. Анализ широты распространения гемолитической и потенциальной биопленкообразующей активности, а также антибиотикорезистентности у кишечной популяции споробиоты птицы необходим для понимания истинной роли аэробных спорообразователей рода Bacillus в экологии кишечного микробиома птицы. Цель работы. Идентификация и исследование биологических характеристик (гемолитическая активность, потенциальная способность к биопленкообразованию и антибиотикорезистентность) изолятов бактерий рода Bacillus, выделенных из толстого отдела кишечника птицы.
Материалы и методы. Выделение спорообразующих бактерий из содержимого слепых отростков толстого кишечника птицы проводили путем прогревания образцов. Фенотипическую идентификацию изолятов осуществляли с использованием биохимических тест-панелей API 50CHB (bioMérieux, Франция). Гемолитические свойства определяли на колумбийском агаре (HiMedia Laboratories Pvt Ltd., Индия) с добавлением 5% стерильной дефибринированной крови барана; каталазную активность – в тесте с 10%-й перекисью водорода по ОФС.1.7.2.0012.15; чувствительность к антибиотикам – диско-диффузионным методом со стандартными дисками, импрегнированными антибиотиками в концентрациях от 5 до 30 μg/disk. Скрининг спорообразующих бактерий – продуцентов биопленки проводили качественным методом на сердечно-мозговом агаре (HiMedia Laboratories Pvt Ltd., Индия) с добавлением индикатора конго красного и 5% сахарозы.
Результаты. Установлено, что кишечная популяция аэробной споробиоты слепых отростков толстого кишечника птицы представлена видами B. licheniformis, B. subtilis/amyloliquefaciens, B. mycoides, B. megaterium и B. сereus. Все изученные изоляты были каталазоположительными, не обладали α-гемолитической активностью. У части изолятов отмечена β-гемолитическая активность. Подавляющее большинство изолятов относились к биопленкообразующим фенотипам и проявляли чувствительность к тестируемым антибиотикам.
Заключение. Вегетативные формы спорообразующих бактерий рода Bacillus потенциально могут сохраняться в сложной экосистеме кишечника или временно ассоциироваться с ней. Гемолитически активные кишечные изоляты спорообразующих бактерий не могут считаться безопасными до выяснения действия этого фактора вирулентности на организм животных. Результаты исследований могут быть использованы при отборе кандидатных штаммов бактерий рода Bacillus, выбранных в качестве пробиотиков.
Введение. Бактериальные сообщества существенно влияют на общую производительность сельскохозяйственных предприятий, от них зависит здоровье животных, производство молока, качество и безопасность пищевых продуктов. Зоонозные бактерии не только оказывают негативное воздействие на благополучие животных, но и представляют риск для общественного здравоохранения, поэтому мониторинг видового разнообразия микроорганизмов на молочных фермах для определения преобладающих видов возбудителей и профилей антибиотикорезистентности имеет важное значение.
Цель исследования. Изучение видового разнообразия бактериальных сообществ на молочной ферме и мониторинг распространения антибиотикорезистентности у изолятов Escherichia coli и Proteus mirabilis для своевременной разработки мер по сдерживанию распространения устойчивых к антибактериальным препаратам микроорганизмов.
Материалы и методы. Для достижения поставленной цели проводили идентификацию микроорганизмов методом MALDI-ToF масс-спектрометрии и определяли антибиотикочувствительность выделенных культур с помощью диско-диффузионного метода.
Результаты. Установлено видовое разнообразие микроорганизмов, выделенных из проб экссудата c поверхности ран конечностей крупного рогатого скота, фекалий и образцов корма. Преобладающими микроорганизмами оказались оппортунистические и патогенные Escherichia coli и Proteus mirabilis, для них определены профили антибиотикорезистентности. Один из изолятов Escherichia coli был мультирезистентным, только комбинация амоксициллина и клавулановой кислоты проявила эффективность в подавлении роста данной культуры. Большая доля изолятов Proteus mirabilis обладала устойчивостью к препаратам из группы фторхинолонов и чувствительностью ко всем остальным исследованным антибактериальным средствам.
Заключение. Отмечены факторы, влияющие на видовое разнообразие микроорганизмов в раневом экссудате, фекалиях и кормах. Определение профилей антибиотикорезистентности энтеробактерий позволит провести ротацию антибактериальных препаратов в исследованных животноводческих организациях.
Введение. Ящур – высококонтагиозная, экономически значимая болезнь парнокопытных животных, характеризующаяся везикулярными симптомами. Известны 7 серотипов вируса ящура (A, O, C, SAT 1, SAT 2, SAT 3 и Asia 1), иммунологически отличающихся между собой. В последнее время особое внимание уделяется топотипу вируса ящура SAT2/XIV (South African Territories 2) ввиду его быстрого распространения. Одними из основных методов борьбы с ящуром являются вакцинопрофилактика и оценка иммунного статуса поголовья восприимчивых животных.
Цель исследования. Разработка и испытание иммуноферментной тест-системы на основе непрямого жидкофазного блокирующего варианта иммуноферментного анализа для определения антител к структурным белкам вируса ящура топотипа SAT2/XIV для оценки эффективности противоящурной вакцины на основе антигена вируса ящура штамма SAT-2/XIV/2023 при ее производстве и последующем применении.
Материалы и методы. Исследуемым материалом служили экспериментальные образцы сыворотки крови крупного рогатого скота, свиней и белых мышей. Испытание разработанной иммуноферментной тест-системы для оценки уровня поствакцинальных антител к вирусу ящура топотипа SAT2/XIV проводили в сравнении с коммерческими наборами: для определения антител к вирусу ящура SAT 2 (ФГБУ «ВНИИЗЖ», Россия) и Solid-phase competitive ELISA for antibodies specific to FMDV serotype SAT 2 (IZSLER & The Pirbright Institute, Италия/Великобритания).
Результаты. Эффективность предложенной тест-системы в регистрации выработки антител к вирусу ящура топотипа SAT2/XIV была выше, чем у других иммуноферментных тест-систем, обладающих выраженной топотипоспецифичностью к возбудителю ящура топотипа SAT2/VII. У отдельных особей крупного рогатого скота специфические антитела выявляли на 7-е сут после вакцинации. Высокие значения диагностической чувствительности (90%), диагностической специфичности (98%) и диагностической точности (95%) определили высокую степень согласованности результатов реакции иммуноферментного анализа с известным диагностическим статусом обследуемых животных (κ-критерий – 0,896).
Заключение. Таким образом, иммуноферментная тест-система для оценки гуморального иммунитета против вируса ящура топотипа SAT2/XIV, имеющая 100%-ю степень гомологии с вакцинным штаммом, обладающая высокими диагностическими показателями, является надежным инструментом оценки качества вакцины против ящура SAT2/XIV.
Введение. Воспаление представляет собой сложный биологический процесс, направленный на защиту организма от патогенов и восстановление поврежденных тканей. Этот процесс регулируется множеством сигнальных молекул, среди которых важное значение имеют пурины и цитокины. Пуринергическая сигнализация, опосредованная аденозинтрифосфатом, аденозинмонофосфатом и другими нуклеотидами, играет ключевую роль в регуляции иммунных реакций и воспалительных процессов. Цитокиновая сеть, включающая интерлейкины, фактор некроза опухоли α и другие молекулы, также является важным компонентом воспаления, обеспечивая коммуникацию между клетками иммунной системы и регулируя их активность. Понимание механизмов взаимодействия между пуринергической сигнализацией и цитокиновой сетью имеет важное значение для разработки новых стратегий лечения воспалительных заболеваний.
Цель исследования. Обобщение результатов исследований по значению роли пуринергической сигнализации и цитокиновой сети в воспалительном процессе у животных.
Материалы и методы. Проведен анализ 55 научных публикаций российских и иностранных авторов за период с 2000 по 2021 г., исследующих влияние нуклеотидов, нуклеозидов и пуринергических рецепторов на формирование иммунного ответа, а также механизмы активации макрофагов и выделения цитокинов. Для поиска источников использовались базы данных eLIBRARY. RU, CyberLeninka, PubMed, NCBI, ResearchGate, CABI и Google Scholar. Результаты. Рассмотрены механизмы воспалительного ответа, включая роль различных клеток и молекул, таких как цитокины и рецепторы, в регуляции иммунной реакции. Последние имеют важное значение в активации клеток иммунной системы и регуляции воспалительных реакций. Обсуждается процесс дефосфорилирования аденозинтрифосфата с участием ферментов CD39 и CD73, что способствует образованию аденозина и активации противовоспалительных механизмов. Проанализированы функции провоспалительных цитокинов, таких как интерлейкин-1, фактор некроза опухоли α и интерлейкин-6, в контексте активации макрофагов и миграции нейтрофилов к месту воспаления. Подчеркивается важность регуляции этих процессов для предотвращения чрезмерного воспалительного ответа и обеспечения гомеостаза. Рассмотрены механизмы перехода между фазами воспаления, включающие роль противовоспалительных цитокинов, таких как интерлейкин-10 и трансформирующий фактор роста β, в контроле активности нейтрофилов и разрешении воспалительного процесса.
Заключение. Дальнейшее изучение данной темы способно углубить современные знания ученых о механизмах возникновения воспаления и создать основу для разработки инновационных терапевтических стратегий, направленных на лечение болезней, обусловленных нарушениями иммунной системы.
Введение. Широкое распространение антибиотикорезистентности среди представителей вида Escherichia coli является острой проблемой животноводческих и птицеводческих хозяйств, поскольку этот возбудитель является наиболее часто регистрируемым компонентом этиологической структуры желудочно-кишечных заболеваний молодняка сельскохозяйственных животных и птицы, а также нередко выявляется при заболеваниях других органов и систем. Уже сейчас во многих хозяйствах затруднено применение антибактериальных препаратов для лечения заболеваний, вызванных данным патогеном, ввиду циркуляции штаммов, обладающих множественной устойчивостью к большинству применяемых в ветеринарной практике антибиотиков. Известно, что со временем чувствительность микроорганизма к различным группам антибактериальных препаратов изменяется, и нередко весьма значительно. Мониторинг чувствительности может помочь в сдерживании распространения антибиотикорезистентности и оптимальном подборе препаратов для применения их в терапии.
Цель исследования. Анализ и систематизация представленных в научной литературе результатов исследований по изучению устойчивости Escherichia coli к антибактериальным препаратам.
Материалы и методы. Проведен поиск работ по заявленной теме в научных журналах и материалах научно-практических конференций. Результаты. В статье представлены и обобщены литературные данные о тенденциях в резистентности Escherichia coli к антибактериальным препаратам.
Заключение. Устойчивость Escherichia coli чаще проявляется к β-лактамным антибактериальным препаратам, аминогликозидам, а также тетрациклинам, макролидам (эритромицину) и линкозамидам (линкомицину). Практически во всех исследованиях установлено, что выделенные изоляты Escherichia coli характеризуются полирезистентностью (устойчивостью к двум и более препаратам), а в некоторых случаях и мультирезистентностью (устойчивостью по крайней мере к одному препарату из трех и более групп). Результаты определения чувствительности во многих исследованиях значительно отличаются друг от друга, что связано с неодинаковыми условиями формирования антибиотикорезистентности у бактерий на разных животноводческих предприятиях. Для более точной оценки динамики распространения антибиотикорезистентности внутри вида Escherichia coli необходимо продолжать изучение чувствительности к антимикробным препаратам различных штаммов, выявляемых в животноводческих и птицеводческих хозяйствах, а также из объектов окружающей среды.
Введение. На достоверность результатов, получаемых при проведении ПЦР-диагностики, могут влиять такие факторы, как ошибки оператора, неполадки в работе амплификатора, наличие в образце ингибиторов реакции, низкое качество реактивов и другое. Все это может приводить к появлению так называемых ложноотрицательных результатов. Цель исследования. Разработка системы внутреннего контроля на основе гетерологичного вируса ньюкаслской болезни при детекции вируса бешенства методом полимеразной цепной реакции.
Материалы и методы. В качестве внутреннего контрольного образца использовалась «Вакцина против ньюкаслской болезни из штамма «Ла-Сота» сухая живая» производства ФГБУ «ВНИИЗЖ» (Россия). РНК из образцов выделяли с помощью набора реагентов «РИБО-сорб» (ФБУН «Центральный научно-исследовательский институт эпидемиологии» Роспотребнадзора, Россия). Для полимеразной цепной реакции с обратной транскрипцией использовали реактивы фирмы Promega (США) и олигонуклеотиды производства ООО «Синтол» (Россия).
Результаты. В качестве объекта для внутреннего контрольного образца выбран штамм «Ла-Сота» вируса ньюкаслской болезни. Проведен дизайн праймеров. В серии экспериментов установлено, что ПЦР-система для внутреннего контрольного образца не конкурирует с ПЦР-системой для вируса бешенства при их совместном использовании. Оптимизированы основные параметры обратной транскрипции и полимеразной реакции. Проведена валидация разработанной методики, в ходе которой определялись такие характеристики, как правильность, специфичность, чувствительность, промежуточная прецизионность в условиях повторяемости (сходимость) и промежуточная прецизионность в условиях воспроизводимости (воспроизводимость). По результатам валидации полученные характеристики метода соответствуют требуемым.
Заключение. На основе штамма «Ла-Сота» вируса ньюкаслской болезни разработана система внутреннего контрольного образца для использования совместно с методикой выявления вируса бешенства методом полимеразной цепной реакции с обратной транскрипцией, позволяющая контролировать ход всех этапов анализа в каждой реакционной пробирке. Данная система при надлежащей оптимизации потенциально может применяться также в экспериментальных научных исследованиях в соответствующих профильных научных организациях при ПЦР-диагностике заболеваний, вызываемых другими РНК-содержащими вирусами.
Введение. Нижнее Поволжье, в том числе Волгоградская область, вплоть до настоящего времени относится к числу наиболее неблагополучных по бешенству регионов России. Сведения о генетическом разнообразии возбудителя бешенства в современный период для Волгоградской области представлены недостаточно, поэтому филогенетический анализ изолятов вируса бешенства из этого региона представляется актуальной научной задачей.
Цель исследования. Проведение филогенетического анализа современных изолятов вируса бешенства, выделенных от животных на территории Волгоградской области, на основании полноразмерной последовательности гена нуклеопротеина.
Материалы и методы. Использовали головной мозг животных с диагнозом «бешенство». Анализ полученных нуклеотидных последовательностей гена нуклеопротеина вируса бешенства проводили с помощью байесовского метода строгих молекулярных часов. Ландшафтно-географическая карта Natural Earth использована для описания пространственного распределения изолятов возбудителя бешенства.
Результаты. Определена полноразмерная последовательность гена нуклеопротеина 13 изолятов вируса бешенства из Волгоградской области. Филогенетический анализ позволил установить, что представители популяции возбудителя бешенства из этого региона относятся к различным генетическим вариантам группы С, сформировавшимся в разное время. Генетическое родство с изолятами из Казахстана, Молдовы, центральных и южных регионов России, с Украины свидетельствует об интенсивном перемещении вируса бешенства на юге европейской части России. В то же время разные варианты вируса бешенства обнаружены на левом и правом берегах Волги.
Заключение. Все изученные изоляты возбудителя бешенства из Волгоградской области принадлежали к генетической группе С и отличались высоким генетическим разнообразием вариантов.
Введение. На территории Российской Федерации регистрируются эпизоотии бешенства природного типа, которые характеризуются стабильно высокой инцидентностью среди диких и домашних животных. Непрерывность эпизоотического процесса бешенства обеспечивается биологической резервацией вируса Lyssavirus rabies в популяциях диких хищников семейства псовых, преимущественно в популяции рыжей лисицы (Vulpes vulpes). Экология и этология лисиц предопределяют территорию распространения бешенства, сезонную динамику инцидентности и видовой состав животных, вовлекаемых в эпизоотический процесс.
Цель исследования. Проведение пространственно-временного анализа данных мониторинга бешенства за 35-летний период для исследования факторов, определяющих особенности современной эпизоотической ситуации.
Материалы и методы. На платформе реляционной системы управления базами данных Microsoft Access (www. microsoft. com) были агрегированы данные о вспышках бешенства на территории Российской Федерации, о проведении антирабической вакцинации среди диких животных, а также о природно-сельскохозяйственном районировании. Для выполнения пространственного анализа вся эпизоотологическая информация базы данных была геокодирована и представлена в виде наборов векторных карт в тематическом проекте геоинформационной системы. Построение ГИС-проекта проводилось на платформе QGIS Desktop (www. qgis. org).
Результаты. Современный нозоареал бешенства охватывает территорию, которая затрагивает большую часть регионов Российской Федерации. Основная зона стабильно высокой инцидентности бешенства приходится на биомы лесостепей, смешанных и широколиственных лесов Восточно-Европейской равнины. На территории Российской Федерации максимальное количество случаев бешенства регистрируется среди лисиц. Эпизоотии бешенства в природных экосистемах сопровождаются эффектом «перелива» (spillover effect) с активным распространением болезни среди различных видов домашних животных. Основную группу эпизоотологического риска составляют собаки, кошки и крупный рогатый скот. Оральная антирабическая вакцинация диких хищников обеспечила формирование выраженного тренда на снижение заболеваемости животных бешенством с одновременным уменьшением амплитуды колебаний кривой инцидентности в периоды многолетних эпизоотических циклов.
Заключение. Регистрируемое снижение инцидентности бешенства на территории Российской Федерации не сопровождается значимым уменьшением площади нозоареала. Это свидетельствует о необходимости коррекции проводимых противоэпизоотических мероприятий с разработкой программы по обеспечению полной элиминации циркулирующих полевых штаммов Lyssavirus rabies из неблагополучных экосистем.
Введение. На современном этапе бешенство продолжает оставаться одним из самых опасных инфекционных заболеваний зоонозной природы. Республика Беларусь является неблагополучной по бешенству животных, при этом заболевание регистрируется во всех регионах страны.
Цель исследования. Целью работы являлись оценка эпизоотической ситуации по бешенству в республике и обобщение современных подходов к диагностике и профилактике заболевания.
Результаты. Приведены актуальные данные об эпизоотической и эпидемиологической ситуации по бешенству в Республике Беларусь. Бешенство на территории республики протекает в виде эпизоотии природного типа, в которую она была вовлечена совместно с граничащими государствами (Польша, Литва, Латвия, Украина, Россия). Чаще всего резервуаром вируса бешенства являются дикие плотоядные животные (70% от всех зарегистрированных случаев): лисицы, енотовидные собаки и волки. На втором месте – домашние плотоядные (кошки, собаки), в единичных случаях – сельскохозяйственные животные. В статье описаны основные направления работы ветеринарной и санитарно-эпидемиологической службы Республики Беларусь, включая специфическую профилактику бешенства среди домашних плотоядных животных, оральную антирабическую вакцинацию диких плотоядных животных и информационную работу с населением, приводятся исторические и современные данные о вакцинации и ее эффективности, представлены основные стратегические направления Комплексного плана профилактики бешенства на 2021–2025 гг., приведены данные об эффективности отдельных мероприятий плана.
Заключение. В Республике Беларусь проблема бешенства остается актуальной, в первую очередь она касается дикой фауны. Основополагающими методами борьбы с заболеванием являются оральная антирабическая вакцинация диких животных и информационная работа с населением. Для стойкого уменьшения количества случаев бешенства в дикой и домашней фауне, а также для снижения рисков заболевания людей считаем необходимым дальнейшее расширение площадей оральной антирабической вакцинации, а также усиление контроля и интенсивности программы антирабической вакцинации домашних плотоядных животных.
Бешенство – широко распространенное инфекционное заболевание млекопитающих животных, в том числе человека. Заболевание проявляется нарушением функции центральной нервной системы. Эпизоотическая ситуация по бешенству в мире остается напряженной, не отличается ситуация и в странах СНГ. Для достижения стойкого благополучия по бешенству необходим комплексный подход. Решением Межправительственного совета по сотрудничеству в области ветеринарии Содружества Независимых Государств от 12 мая 2016 г. ФГБУ «ВНИИЗЖ» было поручено подготовить проект Комплекса совместных действий государств – участников СНГ по профилактике и борьбе с бешенством на период до 2025 г. Комплекс был разработан и утвержден решением Совета глав правительств СНГ от 1 июня 2018 г. В статье подводятся итоги реализации Комплекса совместных действий до 2025 г. и освещается разработка Комплекса совместных действий на 2025–2030 гг., основной целью которого является минимизация риска распространения очагов бешенства на территории государств – участников СНГ.
Статистика статьи
Статистика просмотров за 2026 год.
Издательство
- Издательство
- ФГБУ «ВНИИЗЖ»
- Регион
- Россия, Владимир
- Почтовый адрес
- Россия, 600901, г. Владимир, мкр. Юрьевец
- Юр. адрес
- 600901, ВЛАДИМИРСКАЯ ОБЛАСТЬ, Г. ВЛАДИМИР, МКР ЮРЬЕВЕЦ, МКР. ЮРЬЕВЕЦ
- ФИО
- Рыбин Роман Николаевич (Руководитель)
- E-mail адрес
- arriah@fsvps.gov.ru
- Контактный телефон
- +7 (903) 8991501
- Сайт
- https://arriah.ru